Überspannung
Die Standardredoxpotenziale beschreiben die thermodynamischen Gegebenheiten einer Elektrolysereaktion. Wie alle chemischen Reaktionen haben aber auch elektrochemische Reaktionen eine Aktivierungsenergie und damit einen kinetischen Aspekt. Die Aktivierungsenergie macht sich im Auftreten einer sogenannten Überspannung bemerkbar, die über das Standardredoxpotenzial hinaus angelegt werden muss, damit die Elektrodenreaktion tatsächlich ablaufen kann.
Fließt durch eine Elektrode ein elektrischer Strom, dann verändert sich auch das Elektrodenpotenzial dieser Elektrode. Fließt z. B. ein positiver (anodischer) Strom durch die Elektrode, so tritt eine positive Abweichung zum Elektrodenpotenzial im stromlosen Zustand auf. Wird dagegen die Elektrode von einem negativen (katodischen) Strom durchflossen, treten negative Abweichungen auf. Dies hat seine Ursachen in dem Auftreten von verschiedenen Arten von Überspannungen.
| Die Differenz zwischen dem Potenzial einer Elektrode bei Stromfluss und dem Gleichgewichtselektrodenpotenzial bezeichnet man als Überspannung |
Die Zersetzung des Elektrolyten (Aufsteigen von Gasblasen an den Elektroden) durch Überspannung findet erst bei einer Mindestspannung, der Zersetzungsspannung statt. Die Zersetzungsspannung muss größer sein als die theoretisch aus den Standardelektrodenpotenzialen errechnete Spannung .
So berechnet sich die Überspannung aus:
Die Elektrodenreaktionen laufen in Teilschritten ab. Betrachtet man z. B. die katodische Abscheidung eines Silber-Ions an einer metallischen Elektrode, so kann man folgende Teilvorgänge formulieren:
- Antransport der hydratisierten Silber-Ionen aus dem
Lösungsinneren an die Grenzfläche der elektrischen Doppelschicht - Dehydratisierung der Silber-Ionen
- Durchtritt der dehydratisierten Silber-Ionen durch die elektrische Doppelschicht
- Entladung der Silber-Ionen
- Einbau des Silbers in das Metallgitter
Ist einer dieser Vorgänge besonders langsam, so bestimmt dessen Geschwindigkeit die Gesamtgeschwindigkeit der Elektrodenreaktion. Diese kinetischen Hemmungen der Elektrodenreaktion haben ihre Ursachen in den verschiedensten Arten der Teilreaktionen und dementsprechend unterscheidet man folgende Arten von Überspannungen:
- Diffusionsüberspannung
z. B durch langsame Diffusion der an der Elektrodenreaktion beteiligten Teilchen innerhalb der Elektrolytlösung, - Durchtrittsüberspannung
Ladungsdurchtritt von Ionen durch die elektrische Doppelschicht - Reaktionsüberspannung
Der eigentlichen Durchtrittsreaktion können auch chemische Reaktionen vor- oder nachgelagert sein. Dies können sowohl die Hydratisierung, die Dehydratisierung oder auch eine Komplexbildung sein. - Kristallisationsüberspannung
Die Metall-Ionen können meist nicht an jeder beliebigen Stelle auf der Elektrodenoberfläche bei ihrer elektrochemischen Abscheidung in das Metallgitter eingelagert werden. Oft ist dies nur an besonderen Stellen, sogenannten Keimwachstumsstellen wie Kanten oder Spitzen möglich. Die Kristallisationsüberspannung ist besonders groß bei Metallen mit sehr hohem Schmelzpunkt und sehr gering an flüssigen Metallelektroden (Quecksilber)
-
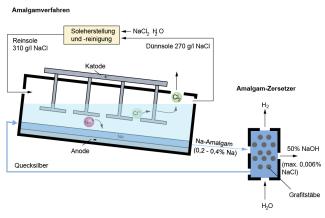
Beim Amalgamverfahren nutzt man bewusst die Überspannung aus.
© Duden Learnattack GmbH
Darüber hinaus ist die Überspannung abhängig vom Elektrodenmaterial und dessen Oberflächenbeschaffenheit. Beispielsweise ist die Überspannung für die Abscheidung von Wasserstoff an sogenanntem platinierten Platin, d. h. Platin, das mit feinverteiltem Platin bedeckt ist, nur 0,02 V, an Quecksilber hingegen beträgt sie 1,0 bis 1,2 V.
Überspannung ist ein teures ökonomisches Problem bei fast allen technischen Elektrolyten. Durch die Überspannung ist der Energieverbrauch wesentlich höher als der, der sich theoretisch aus den Standardpotenzialen ergibt. Beim Membranverfahren der Chloralkali-Elektrolyse beträgt die Differenz der Standardpotenziale 2,07 V . Der zusätzliche Effekt durch die Überspannung jedoch benötigt mindestens 1,0 V. Das heißt, dass etwa 33 % der aufgewendeten Elektroenergie nur durch die Überspannung verbraucht werden. Auf der anderen Seite nutzt man beim Amalgamverfahren (Bild 1) den Effekt der Überspannung aus. Dadurch, dass Wasserstoff an der Amalgamelektrode eine hohe Überspannung hat, scheidet sich dort nicht Wasserstoff, sondern Natrium ab.
-
Unterschiedliche Abscheidepotenziale von Silber, Platin und Grafit
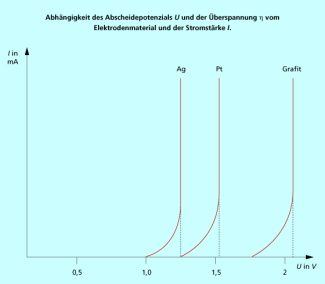
Betrachten wir die möglichen Elektrodenvorgänge bei der Chlor-Alkali-Elektrolyse etwas genauer und berücksichtigen dabei, dass immer die Elektrodenreaktion mit dem kleinsten Abscheidepotenzial abläuft::
1. Katode:
Elektrolysiert man eine wässrige Lösung von Natriumchlorid, so können an der Katode theoretisch Wasserstoff oder Natrium abgeschieden werden.
Das Standardredoxpotenzial für die Wasserstoffabscheidung ist weniger negativ als das für die Abscheidung von Natrium, daher sollte in wässriger Lösung unabhängig vom pH-Wert Wasserstoff gebildet werden (Gleichungen 1 bzw. 2).
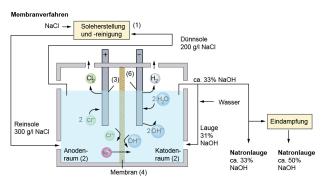
Beim Diaphragma- und dem Membranverfahren (Bild 2) verwendet man eine Eisenkatode, an der die Überspannung von Wasserstoff einen Wert von 0,4-0,8 V hat. Hier wird gemäß Gleichung 1 bzw. 2 Wasserstoff abgeschieden.
Beim Amalgam-Verfahren hingegen wird als Katodenmaterial Quecksilber eingesetzt. Durch die hohe Überspannung, die hier auftritt, wird das Potenzial für die Wasserstoffabscheidung sehr stark negativ verschoben und die Wasserstoffbildung somit erschwert.
Hinzu kommt, dass sich, wenn Natrium an Quecksilber abgeschieden wird, eine Legierung bildet, das Natriumamalgam. Dadurch wird zusätzlich das Potenzial für die Natriumabscheidung positiv verschoben:
Insgesamt ist folglich das Potenzial für die Abscheidung von Natrium an Quecksilber positiver als für die Wasserstoffabscheidung, sodass beim Amalgamverfahren Natriumamalgam gebildet wird.
2. Anode:
Betrachtet man die möglichen Prozesse an der Anode, so können dort theoretisch Sauerstoff oder Chlor abgeschieden werden.
Die Redoxpotenziale für Reaktion (6), die den Bedingungen bei der Elektrolyse entspricht, und für Reaktion (8) sind nahezu gleich. Damit sollten sowohl Chlor als auch Sauerstoff nebeneinander gebildet werden. Das Abscheidepotenzial für Sauerstoff wird aber durch Überspannungseffekte stärker ins Positive verschoben, als das bei Chlor der Fall ist. So betragen z. B. die praktischen Abscheidepotenziale an einer Grafitelektrode für Sauerstoff 1,91 V und für Chlor 1,68 V. Daher wird in der Praxis bei der Elektrolyse Chlor abgeschieden, das je nach Verfahren bis zu 2 % Sauerstoff als Verunreinigung enthalten kann. Für besondere Anwendungen muss dieses Produktgemisch einer speziellen Chlorreinigung unterzogen werden.
-
Beim Membranverfahren spielt die Überspannung bei der anodischen Abscheidung eine wichtige Rolle.
© Duden Learnattack GmbH

