Wasserhärte
Die Härte des Wassers entsteht durch gelöste Salze. In natürlichen Wässern sind das vor allem Magnesium- und Calciumhydrogencarbonat und -sulfat die aus dem Boden gelöst wurden. Je mehr Salze im Wasser gelöst sind desto härter ist das Wasser. Die Wasserhärte ist je nach Beschaffenheit des Bodens von Region zu Region verschieden.
Man unterscheidet dabei zwischen permanenter Härte und temporärer Härte. Die temporäre Härte wird durch den Gehalt an Hydrogencarbonaten verursacht und kann durch Erhitzen entfernt werden. Die permanente Härte wird durch die Sulfate verursacht und bleibt beim Erhitzen unverändert.
Als Maß für die Wasserhärte galt früher in Deutschland das „Grad deutscher Härte“– °dH. Inzwischen gibt man die Wasserhärte allerdings durch die Konzentration der Erdalkaliionen in mmol/l an.
Die Härte des Wassers
Die Härte des Wassers wird verursacht durch die im Wasser gelösten Salze. In natürlichen Wässern sind dies vor allem die Sulfate und die Hydrogencarbonate der Erdalkalimetalle Calcium und Magnesium. Diese werden aus dem Boden durch das Wasser ausgewaschen. Je mehr dieser Salze im Wasser gelöst sind, desto härter ist es. Die Wasserhärte ist also von Region zu Region unterschiedlich und hängt stark von der Beschaffenheit des Bodens ab. In Regionen, die auf kalkfreiem Boden liegen ist das Wasser besonders weich, wie z. B. in Thüringen (Gotha). Besonders hartes Wasser findet man z. B. im Raum Würzburg, bedingt durch den muschelkalkhaltigen Boden in dieser Gegend.
Man unterteilt die Wasserhärte in zwei Arten, die temporäre Härte und die permanente Härte. Unter der temporären Härte versteht man den Gehalt an Calcium- und Magnesiumhydrogencarbonat im Wasser. Sie wird auch als Carbonathärte bezeichnet. In Abhängigkeit vom pH-Wert und der Temperatur des Wassers liegt ein Gleichgewicht zwischen Hydrogencarbonat-Ionen, Carbonat-Ionen und gelöstem CO vor. Es wird als Carbonat-Hydrogencarbonat-Gleichgewicht bezeichnet.
Bei Raumtemperatur und pH-Werten um den Neutralbereich liegt dieses Gleichgewicht auf der Seite des Hydrogencarbonats. Das Calcium- und das Magnesiumhydrogencarbonat sind leicht löslich.
Eine Erhöhung der Temperatur bewirkt, dass sich die Löslichkeit von CO im Wasser verringert und dieses aus dem Wasser entweicht. Dadurch wird das Gleichgewicht in der obigen Reaktionsgleichung nach rechts auf die Seite der Carbonat-Ionen verschoben. Die Zunahme der Carbonat-Ionen-Konzentration führt zum Ausfallen der schwerer löslichen Calcium- und Magnesiumcarbonate. Man kann dies gut beobachten, denn beim Abkochen von Wasser setzt sich Kesselstein ab. Durch das Ausfallen der schwerer löslichen Carbonate verringert sich die Härte des Wassers. Deshalb wird der Anteil der Wasserhärte, der durch die gelösten Hydrogencarbonate verursacht wird als temporäre Härte bezeichnet.
Die permanate Härte wird durch die im Wasser gelösten Sulfate, Nitrate und Chloride verursacht. Es ist also die Nichtcarbonat-Härte. Sie ist permanent, weil sie sich nicht durch Erhitzen beseitigen lässt.
Angegeben wird die Gesamthärte des Wassers, die sich aus der permaneten Härte und der temporären Härte zusammensetzt.
-
Die Wasserhärte kann mit Teststäbchen ermittelt werden.

Das Maß für die Wasserhärte
Als Maß für die Wasserhärte galt in Deutschland früher das „Grad deutscher Härte“- °dH. Das Maß bezog sich ursprünglich auf die im Wasser nicht relevanten Erdalkalimetalloxide. 1°dH entspricht 10 mg/l CaO oder 7,2 mg/l MgO, bzw. 7,14 mg/l Ca oder 4,34 mg/l Mg.
Um ein einheitliches Maß anzugeben, wurde der Gehalt an härtebildenden Ionen auf Calciumoxid umgerechnet. Dies geschieht durch Multiplikation mit einem Faktor, der sich aus den relativen Molekülmassen von Calciumoxid und Magnesiumoxid berechnet. Er beträgt 1,391. 1 Millimol (mmol) Calcium-Ionen auf einem Liter Wasser entspricht 5,608 °dH.
In Frankreich, England und den USA verwendet man andere Härtegrade. So entspricht 1° deutscher Härte 0,798° englischer Härte oder 0,560° französischer Härte und 0,056° amerikanischer Härte.
Inzwischen wird die Wasserhärte allgemein in mmol/l Erdalkali-Ionen angegeben. 1°dH entspricht 0,18 mmol/l Erdalkali-Ionen.
Das Carbonat-Hydrogencarbonat-Gleichgewicht spielt auch in der Natur eine wichtige Rolle:
Die Entstehung von Tropfsteinhöhlen
Betritt man eine Tropfsteinhöhle, ist man von der Formenvielfalt der Gebilde beeindruckt. Tropfsteine in den Höhlen entstanden durch sehr langsame Auflöse- und Ausfällungsprozesse von Kalkstein. Im Regenwasser wird Kohlenstoffdioxid aus der Luft gelöst. Dabei entsteht in geringem Maß Kohlensäure. Wenn das schwach saure Regenwasser durch porösen Kalkstein sickert, bildet sich leicht lösliches Calciumhydrogencarbonat.
Wenn dann aus dem an der Decke einer Höhle hängenden Tropfen das Wasser wieder verdunstet, bildet sich das schwer lösliche Calciumcarbonat zurück in Form der hängenden Stalaktiten. Verdunstet das Wasser an der Auftropfstelle am Boden, wachsen die Stalagmiten nach oben.
-
Härtebereiche des Wassers
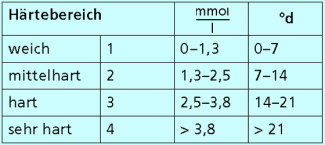
Probleme durch Wasserhärte
Das Erhitzen von hydrogencarbonathaltigem Wasser führt aufgrund der bereits erwähnten Veränderung des Carbonat-Hydrogencarbonat-Gleichgewichtes dazu, dass schwer lösliche Calcium- und Magnesiumcarbonate ausfallen. Diese lagern sich z. B. als Kesselstein an den Heizelementen ab und verringern so die Heizleistung oder können sogar die Heizelemente zerstören. Mit Seifen bilden die gelösten Ca- und Mg-Ionen schwer lösliche Verbindungen (Kalkseifen), sodass die Waschwirkung der Seifen verringert wird. Bei der Verwendung von modernen Tensiden als Waschmittel ist dies zwar nicht mehr so ausgeprägt, aber auch da lohnt sich ein Zusatz von Wasserenthärtern, wie Zeolithe, zum Waschmittel. Der Geschmack von schwarzem Tee wird durch Calcium-Ionen im Wasser beeinflusst. In Brauereien beeinflussen die gelösten Salze den Geschmack der Biere und auch bei der Herstellung von Papier und Beton wirken sich hohe Ionenkonzentrationen im Wasser störend auf die Produktqualität aus.
Enthärtung des Wassers
Für verschiedene technische Anwendungen ist es notwendig, das Wasser zu enthärten. Dafür gibt es mehrere Möglichkeiten.
Die einfachste ist die Destillation des Wassers. Das ist allerdings sehr energieaufwendig.
Eine andere Möglichkeit besteht darin, die störenden Ionen auszufällen. Calcium-Ionen lassen sich z.B. mit Soda als Calciumcarbonat,
oder mit Natriumphosphat als schwer lösliches Calciumphosphat fällen.
.
Eine dritte Möglichkeit ist die Entfernung der störenden Ionen in einem Ionenaustauscher.
In einem ersten Austauschvorgang werden dabei alle Kationen, z. B. die Calcium-Ionen, gegen Protonen ausgetauscht. Der Austausch geschieht mit Protonen, die auf einem Kunstharz als Trägermaterial gebunden sind. Sie werden abgegeben und im Austausch werden die Calcium-Ionen an das Harz gebunden. Dies ist der sogenannte „saure“ Austauscher.
Im zweiten Schritt werden mit sogenannten „basischen“ Austauschern die Anionen, z.B. die Sulfat-Ionen in analoger Weise gegen Hydroxid-Ionen ausgetauscht. Für diesen Austauscher sind Hydroxid-Ionen an ein Kunstharz gebunden, die im Austausch gegen andere Anionen, wie die Sulfationen, abgegeben werden. Durch diese beiden Austauschvorgänge entsteht das sogenannte salzfreie oder deionisierte Wasser das in der Regel allen Ansprüchen z.B. im Labor entspricht. Es wird dort auch statt des früher üblichen destillierten Wasser eingesetzt, das heute nur noch selten verwendet wird.
Wenn man nur die Calcium- und die Magnesium-Ionen als Härtebildner aus dem Wasser entfernen möchte, reicht es aus, nur einen Kationenaustauscher zu nehmen, der mit Natrium-Ionen beladen ist. An diesem werden dann die Calcium- und Magnesium-Ionen gebunden und es gehen im Austausch dafür Natrium-Ionen in Lösung.
Eine weitere Möglichkeit ist der Zusatz von Komplexbildnern. Diese halten dann die Kationen durch Komplexierung in Lösung und berhindern so das Ausfallen von schwer löslichen Salzen aus dem Wasser. Früher wurde z. B. dem Wasser Pentanatriumtriphosphat () als Enthärter zugesetzt, das mit den Erdalkalimetall-Ionen stabile, gut lösliche Komplexe bildet. Da jedoch die Phosphate in den Abwässern zu einer Eutrophierung von Gewässern führen, wurden sie in Europa durch Zeolithe ersetzt.

