Schwefel und Schwefelverbindungen
Schwefel als Element der VI. Hauptgruppe kommt sowohl gediegen als auch in Form von Sulfiden und Sulfaten in der Erdkruste vor. Schwefel und viele Schwefel-Verbindungen sind vor allem in der chemischen Industrie von außerordentlicher Bedeutung. So werden jährlich über 150 Millionen Tonnen Schwefelsäure als einer der wichtigsten Grundstoffe der chemischen Industrie produziert. Diese werden vor allem zur Herstellung von Düngemitteln und zur Aufbereitung von Titanerzen benötigt.
Der hohe Schwefelgehalt in fossilen Brennstoffen trägt zur Entstehung des sauren Regens bei. Das bei der Verbrennung von Kohle, Erdöl und Erdgas entstehende Schwefeldioxid muss deshalb in Entschwefelungsanlagen aus den Abgasen von Industrieanlagen und Kraftwerken entfernt werden.
Schwefel ist ein Element der VI. Hauptgruppe. Das Schwefelatom besitzt 16 Protonen und meist 16 Neutronen im Atomkern sowie 16 Elektronen in der Atomhülle.
Die dritte Elektronenschale ist mit sechs Elektronen unvollständig besetzt, sodass Schwefel über sechs Außenelektronen und 10 Elektronen auf den inneren Schalen verfügt. Um eine stabile Achterschale zu erreichen, kann ein Schwefelatom zwei weitere Elektronen aufnehmen.
Dabei entsteht in ionischen Verbindungen das Sulfid-Ion. Aber auch durch Atombindungen kann eine stabile Elektronenkonfiguration erreicht werden. Als Element der 3. Periode kann Schwefel auch mehr als vier Atombindungen zu geeigneten Partner ausbilden.
-
Schwefel und Schwefelverbindungen waren schon in der Antike bekannt.

Modifikationen
Modifikationen sind verschiedene Erscheinungsformen ein und desselben Stoffes. Modifikationen eines Elements bestehen aus den gleichen Atomen, haben aber durch unterschiedliche Anordnung der Atome (Struktur) unterschiedliche physikalische und z. T. auch chemische Eigenschaften.
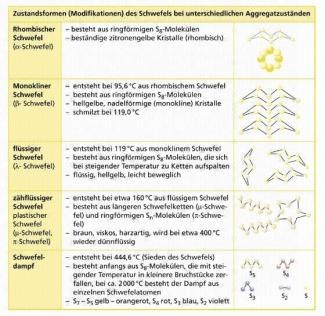
Elementarer Schwefel kommt in verschiedenen, temperaturabhängigen Modifikationen vor, z. B. als rhombischer, monokliner oder plastischer Schwefel. Einzig der rhombische Schwefel ist bei Zimmertemperatur stabil.
Der rhombische Schwefel besteht aus -Molekülen, in denen jedes Schwefelatom mit zwei benachbarten Schwefelatomen verbunden ist. Zwei der Außenelektronen gehen jeweils eine unpolare Atombindung ein, sodass jedes Schwefelatom noch vier nicht bindende Elektronen (zwei Paare) besitzt. Aufgrund seiner gewellten, zackenförmigen Struktur bezeichnet man diese Modifikation auch als Kronenschwefel oder Cyclooctaschwefel.
Rhombischer Schwefel ist bei Zimmertemperatur beständig, fest und bildet rhombische Kristalle. Er ist zitronengelb, nicht wasserlöslich, kaum in organischen Lösungsmitteln, aber sehr gut in Schwefelkohlenstoff löslich.
Reaktionen des Schwefels
Cyclooctaschwefel ist bei Raumtemperatur wenig reaktionsfähig. Bei höheren Temperaturen reagiert er jedoch direkt mit vielen Metallen und Nichtmetallen. An der Luft verbrennt er nach Entzündung in einer exothermen Reaktion mit blauer Flamme zu Schwefeldioxid.
Mit Wasserstoff oder Halogenen kann Schwefel ebenfalls direkt umgesetzt werden.
-
Modifikationen des Schwefels
Mit vielen Metallen bildet Schwefel nach Erhitzen Metallsulfide (Bild 3). Auch für diese Reaktion z. B. von Schwefel mit Eisen muss Schwefel erst thermisch aktiviert werden.
Vorkommen und Bedeutung
Schwefel kommt sowohl elementar, als auch in vielen Mineralien vor, z. B. in Sulfiden und Sulfaten. Sulfid-Minerale heißen Kiese (Schwefelkies, ), Glanze (Bleiglanz, PbS) und Blenden (Zinkblende, ZnS). Sulfat-Minerale sind z. B.
Gips (), Bittersalz .
-
Bildung von Eisen(II)-sulfid aus den Elementen

Heinz Mahler - H. Mahler, Fotograf, Berlin
Ca. 20% der Weltproduktion des Schwefels werden nach dem FRASCH-Verfahren aus den elementaren Vorkommen gewonnen. Dabei wird mit überhitztem Wasserdampf (160 °C, 25 bar) der Schwefel unter Tage geschmolzen und mit Druckluft an die Erdoberfläche gepresst. Der dabei geförderte Schwefel ist bereits sehr rein (99,5 - 99,9%).
Die Hauptmenge des Schwefels wird heute nach dem CLAUS-Prozess aus -haltigen Gasen (Erdgas, Raffineriegas) hergestellt. Dabei wird zuerst ein Teil des Schwefelwasserstoffs zu Wasserdampf und Schwefeldioxid verbrannt.
Die Sauerstoffzufuhr muss so eingestellt werden, dass nur ein Drittel des Schwefelwasserstoffs zu Schwefeldioxid umgesetzt wird, sodass in der nachgeschalteten Reaktorzelle ein - Verhältnis von 2:1 vorliegt. Dabei entsteht dann elementarer Schwefel.
Schwefel ist ein wichtiger Ausgangsstoff für die chemische Industrie.
Er wird zur Herstellung von Schwefelsäure, Sprengstoffen, Schwefelkohlenstoff, Schwefelfarbstoffen und für die Vulkanisation von Kautschuk verwendet.
Schwefel-Sauerstoff-Verbindungen
Die Schwefel-Sauerstoff-Verbindungen sind die Oxide, Sauerstoffsäuren und deren Salze, von denen eine große Vielfalt existiert. Die wichtigsten Vertreter sind Schwefeldioxid, Schwefeltrioxid, Schwefelsäure und die Salze der Schwefelsäure, die Sulfate, die alle wichtige Zwischen- oder Endprodukte der chemischen Industrie sind.
Schwefeldioxid, , ist farblos, stechend riechend, gasförmig, giftig und wasserlöslich. Bei der Reaktion mit Wasser entsteht eine Lösung, die gelöstes Schwefeldioxid, Oxonium-Ionen und Hydrogensulfit-Ionen enthält und als schweflige Säure bezeichnet wird.
Schwefeldioxid kommt in vulkanischen Gasen vor und entsteht beim Verbrennen fossiler Brennstoffe. Da es mit der Luftfeuchte und dem Sauerstoff der Atmosphäre Schweflige Säure und Schwefelsäure bildet, ist es neben anderen sauren Gasen an der Entstehung des sauren Regens beteiligt. Um die Umweltschäden durch sauren Regen zu minimieren, müssen die Abgase von Industrieanlagen wie Kohlekraftwerke, Schwefelsäureanlagen und Erdölraffinerien aufwendig gereinigt werden.
Zur Reduzierung der SO2-Emission wird das Rauchgas von Kraftwerken und anderen Anlagen der Rauchgasentschwefelung unterzogen. Durch Einsprühen einer Suspension von Calciumcarbonat und Einblasen von Luft wird das SO2 in Gips überführt.
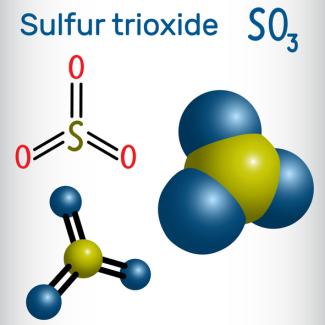
Schwefeltrioxid, , ist im Gaszustand ein vieratomiges Molekül. Es besteht aus einem Schwefelatom und drei Sauerstoffatomen, die durch polare Atombindungen miteinander verbunden sind (Bild 7).
Schwefeltrioxid ist eine feste Substanz, die in drei Modifikationen auftreten kann. Es ist stark Wasser anziehend (hygroskopisch) und wirkt oxidierend. Mit Wasser reagiert Schwefeltrioxid unter starker Wärmeentwicklung heftig zu Schwefelsäure.
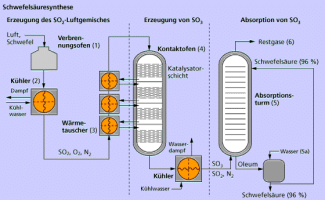
Schwefeltrioxid wird technisch durch katalytische Oxidation aus Schwefeldioxid als Zwischenprodukt bei der Synthese von Schwefelsäure gewonnen.
Daneben dient es als Ausgangsstoff für die Herstellung von Chlorsulfonsäure, und zur Sulfonierung (Einführung der Sulfogruppe) organischer Substanzen, z. B. in der Waschmittelindustrie oder der Arzneistoffsynthese.
Reine Schwefelsäure ist eine farblose, ölige Flüssigkeit, die bereits bei 10,4 °C erstarrt. Auf der Haut wirkt die Säure stark ätzend. Die konzentrierte Schwefelsäure enthält zu etwa 4 % Wasser. Schwefelsäure ist mit Wasser in beliebigem Verhältnis mischbar.
Die Reaktion mit Wasser (Protolyse) verläuft ebenfalls stark exotherm.
-
das Schwefeltrioxid-Molekül
Bacsica - iStock
Schwefelsäure wird in drei Schritten aus Schwefel, Sauerstoff und Wasser hergestellt (Bild 8). Sie ist mit einer Menge von 150 Millionen Tonnen pro Jahr die am meisten produzierte Chemikalie auf der Welt.
Die Verwendung ist äußerst vielfältig, der Hauptanteil von 65% dient der Herstellung von Düngemitteln. Außerdem wird die Säure zur Gewinnung von Titanoxid, zur Herstellung von Sprengstoffen, von Zellwolle und Kunstseide oder als Akkumulatorsäure benötigt.
Sulfate sind die Salze der Schwefelsäure und kommen in der Natur häufig vor, z. B. Calciumsulfat (in der wasserfreien Form als Anhydrit oder als Gips ). Sie werden z. B. wie Gips als Baustoffe oder wie Bittersalz als Düngemittel verwendet. Bariumsulfat dient als weißes Füllmaterial und zur Herstellung von Kunstdruckpapier.
-
Schema der Schwefelsäuresynthese
Schwefelwasserstoff und Sulfide
Schwefelwasserstoff ist eine Molekülverbindung. Das Molekül besteht aus einem Schwefelatom und zwei Wasserstoffatomen, die durch polare Atombindungen miteinander verbunden sind. Anders als Wasser ist Schwefelwasserstoff gasförmig und riecht stechend nach faulen Eiern. Es ist sehr giftig und lähmt das Atemzentrum.
Schwefelwasserstoff ist wasserlöslich und ein gibt in wässrigen Lösungen seine Protonen ab. Aus diesem Grund reagieren wässrige Lösungen von Schwefelwasserstoff schwach sauer.
In der Natur kommt Schwefelwasserstoff in vulkanischen Gasen, im Erdöl und Erdgas und bei der Zersetzung von Eiweiß durch Fäulnis, z. B. bei der Verwesung, vor. Technisch wird Schwefelwasserstoff aus den Elementen hergestellt.
Schwefelwasserstoff wird in der analytischen Chemie als Nachweisreagenz verwendet. Es bildet mit vielen Metall-Ionen schwer lösliche Sulfide in verschiedenen Farben.
Sulfide sind die Salze der Schwefelwasserstoffsäure. Es sind feste, kristalline Stoffe, die neben Schwefel Metalle enthalten. Sie kommen in der Natur als sulfidische Erze vor und wurden früher wie Pyrit, , in großem Umfang zur Herstellung von Schwefeldioxid eingesetzt.
Andere Sulfide, z.B. Quecksilbersulfid (Zinnoberrot), Bleisulfid (Bleiglanz), Cadmiumsulfid (Cadmiumgelb), Zinksulfid (Zinkblende), Antimonsulfid (Grauspießglanz) oder Arsensulfid (Auripigment), finden ihre Verwendung als Künstlerfarben oder Schminken.
Die Schwarzfärbung von Silbergegenständen in Raumluft beruht auf der oberflächlichen Bildung von Silbersulfid, da der Mensch geringste Spuren Schwefelwasserstoff mit der Atemluft ausscheidet.
Ag + 0,5 O2 + H2S –→ Ag2S + H2O
Organische Schwefel-Verbindungen
Schwefel kann in organischen Verbindungen den Sauerstoff ersetzen. Solche Verbindungen nennt man Thio-Verbindungen (griech.: theion = Schwefel), sie sind deutlich seltener als die entsprechenden Sauerstoffverbindungen. Verwendung finden Thioharnstoff als Zusatzstoff zur Herstellung von Farbstoffen und Kunststoffen sowie Thioalkohole als Haarbehandlungsmittel für Dauerwellen beim Frisör. In vielen biologischen Prozessen spielen Thioaminosäuren eine Rolle.

