Alkane
Alkane bestehen aus den zwei Elementen Kohlenstoff und Wasserstoff. In ihren Molekülen bilden die Valenzelektronen aller Kohlenstoffatome mit dem Valenzelektronen eines Wasserstoffatoms oder eines anderen Kohlenstoffatoms ein gemeinsames Elektronenpaar. Trotz der relativ einfachen Struktur gibt es unzählige verschiedene Alkane.
Einige sind gasförmig, andere sind flüssig, dickflüssig oder sogar wachsartig bis fest. Sie bilden kürzere oder längere, weit verzweigte aber ebenso auch unverzweigte Ketten aus. In der Natur kommen sie neben einigen anderen Kohlenwasserstoffen im Erdöl und im Erdgas vor, man kann sie aber auch gezielt herstellen.
Bau der Alkane
Der Name Alkan ist der von der IUPAC empfohlene Name. Im technischen Schrifttum findet sich allerdings immer noch der Name Paraffine (lat.: parum affinis = wenig reaktionsfähig).
Alkane werden in der Fachliteratur oft auch als Aliphate n bezeichnet. Sie sind die einfachsten Kohlenwasserstoffe und bestehen nur aus den Elementen Kohlenstoff und Wasserstoff. In den Alkanen sind alle Kohlenstoffatome -hybridisiert. Sie sind also mit vier weiteren Atomen über Einfachbindungen verknüpft und werden auch als gesättigte Kohlenwasserstoffe bezeichnet. Die endständigen Kohlenstoffatome sind mit drei Wasserstoffatomen verbunden, die mittleren mit zwei Wasserstoffatomen.
Liegen Verzweigungen der Kette vor, dann kann ein Kohlenstoffatom auch mit nur einem oder gar keinem Wasserstoffatom verbunden sein. Danach richtet sich auch die nähere Bezeichnung dieser Kohlenstoffatome. Ist ein Kohlenstoffatom an einer endständigen Position in der Alkankette, spricht man auch von einem primären Kohlenstoffatom, da es nur mit einem weiteren C-Atom verbunden ist. Trägt es zwei C-Atome als Substituenten, spricht man von einem sekundären, bei drei C-Atomern als Substituenten von einem tertiären Kohlenstoffatom. Sind alle vier Bindungsmöglichekeiten des Kohlenstoffs mit weiteren Kohlenstoffatomen substituiert, bezeichnet man dieses C-Atom als quarternär.
Das vorliegen gesättigter Kohlenwasserstoffe wird im Namen durch die Endung -an angezeigt. Die Anzahl der Kohlenstoffatome , die miteinander verknüpft sind, wird durch den Wortstamm angegeben, wobei die griechischen Namen für die Zahlen zugrundeliegen.
Die allgemeine Formel für alle Alkane lautet .
Für das Beispiel Octan ist n=8, daraus folgt als Summenformel für Octan: .
Ausführliche Strukturformel für ein kettenförmiges, unverzweigtes Alkan (n-Octan):
![]()
In Alkanen können auch Verzweigungen vorliegen. Dadurch können Verbindungen entstehen, die zwar die gleiche Summenformel haben, aber sich doch in ihrer Zusammensetzung (lat. = konstitution) unterscheiden. Es gibt also z.B. mehrere verschiedene Octane. Man spricht in diesem Fall von Isomeren, speziell von Konstitutionsisomeren.
2,2,4-Trimethylpentan ist ein beispiel für ein Isomeres des Octan, da es auch die Summenformel hat.
![]()
Je länger die Kohlenwasserstoffketten werden, desto zahlreicher werden die verschiedenen Isomere.
Eigenschaften der Alkane
Aufgrund der strukturellen Merkmale sind einige Eigenschaften für Alkane typisch.
Wasserlöslichkeit
Alkane sind kaum in Wasser löslich, in organischen Lösungsmitteln lösen sie sich aber gut. Die Ursache für die schlechte Wasserlöslichkeit der Alkane liegt in ihrem Bau. Um den Zusammenhang zu verstehen, muss man ihre räumliche Struktur und die Kräfte, die zwischen den Molekülen herrschen, im Vergleich zum Bau der Wassermoleküle und den Alkanmolekülen betrachten. Hier wird dieser Zusammenhang am Beispiel von Methan ( erklärt.
Methan besteht aus einem zentralen Kohlenstoffatom, das über Einfachbindungen mit vier Wassertstoffatomen verbunden ist. Die vier bindenden Elektronenpaare nehmen den größtmöglichen Abstand zueinander ein. Dadurch weisen die Wasserstoffatome in die Ecken eines Tetraeders, in dessen Mitte sich das Kohlenstoffatom befindet. Die bindenden Elektronenpaare werden von dem Atomkern des Kohlenstoffatoms und der Wasserstoffatome fast gleich stark angezogen. Daher bilden sich im Molekül keine Ladungsschwerpunkte aus. Das Methanmolekül ist unpolar.
Im Wassermolekül ist das Sauerstoffatom ebenfalls von vier Elektronenpaaren umgeben. Davon sind jedoch nur zwei bindend, die anderen beiden sind nicht bindend. Da nicht bindende Elektronenpaare einen größeren Raum einnehmen als bindende, ergeben sich im Wassermolekül andere Winkel. Außerdem zieht der Atomkern des Sauerstoffatoms die gemeinsamen Elektronenpaare stärker an als die Wasserstoffatome (polare Atombindung). Dadurch entsteht dort ein negativer Ladungsschwerpunkt, der durch die nicht bindenden Elektronenpaare noch verstärkt wird. An den Wasserstoffatomen entsteht dagegen eine positive Teilladung. Das Wassermolekül ist ein Dipol.
In Abhängigkeit vom unterschiedlichen Bau der Methan- und Wassermoleküle ergeben sich auch jeweils unterschiedliche zwischenmolekulare Kräfte. Obwohl die Methanmoleküle unpolar sind, kommt es durch die Bewegung der Elektronen zur gegenseitigen Beeinflussung der Moleküle und zu schwachen zwischenmolekularen Kräften (Van-der-Waals-Kräfte). Sie sind umso stärker, je größer die Oberfläche und je größer die Masse der Moleküle sind.
Durch den Dipolcharakter der Wassermoleküle kommt es zwischen ihnen zu ganz anderen Wechselwirkungen. Es bilden sich sogenannte Wasserstoffbrückenbindungen aus, indem sich ein Wassermolekül mit einem positivierten Wasserstoffatom an das negativierte Sauerstoffatom eines anderen Moleküls anlagert.
-
Vergleich von Methan- (oben) und Wassermolekül (unten)
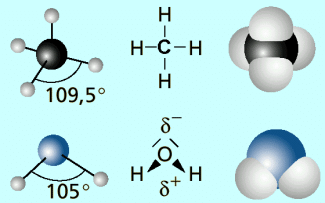
Der Bau der Moleküle und die daraus resultierende Art der zwischenmolekularen Kräfte bestimmt, ob zwei Stoffe miteinander mischbar sind oder einer im anderen löslich ist. Unter Löslichkeit oder Mischbarkeit versteht man die Fähigkeit der Stoffe, miteinander homogene Mischungen zu bilden. Eine erhebliche Rolle spielen dabei Dipolmoment, Wasserstoffbrückenbindungen und VAN-DER-WAALS-Kräfte. So sind die unpolaren Alkanmoleküle in unpolaren Lösungsmitteln, wie z. B. anderen Alkanen, gut löslich. Im Wasser jedoch sind die Alkane praktisch unlöslich. Die zur Lösung der Wasserstoffbrückenbindungen nötige Energie ist viel größer als die zum Lösen der VAN-DER-WAALS-Kräfte zwischen den Alkanmolekülen. Damit bleiben die beiden Stoffe isoliert und bilden Schichten. Es gilt: Ähnliches löst sich in Ähnlichem.
Reaktion mit Sauerstoff
Aufgrund der in den Molekülen enthaltenen Kohlenstoff- und Wasserstoffatome reagieren Alkane bei ausreichend Sauerstoffzufuhr vollständig zu Kohlenstoffdioxid und Wasser.
Vollständige Verbrennung von Methan:
Bei unzureichender Sauerstoffzufuhr erfolgt eine unvollständige Verbrennung. Dabei entsteht Kohlenstoffmonooxid oder auch Ruß (Kohlenstoff).
Unvollständige Verbrennung von Methan:
Substitution
Wasserstoffatome von Alkanen können durch andere Atome, z. B. Halogenatome, ersetzt werden. Diese Reaktion ist eine typische chemische Eigenschaft der Alkane. Man spricht von einer Substitutionsreaktion.
Das ausgetauschte Atom ist ein Substituent. Es entsteht ein Derivat der Ausgangsverbindung, das dann kein Kohlenwasserstoff mehr ist. Besonders wichtig sind die Halogenderivate der Alkane, die Halogenalkane. Sie lassen sich gezielt und direkt aus den Alkanen und den Halogen herstellen, und dienen u. a. auch als Vorläufer für die Erzeugung anderer Stoffklassen, da sich die Halogenatome besonders gut durch diveres andere Atome und Atomgruppen austauschen lassen. Damit dient die Erzeugung von Halogenalkanen aus den reinen Alkanen quasi als "Funktionalisierung" der sonst recht reaktionsträgen Alkane.
![]()
Eine weitere typische Reaktion der Halogenlkane ist die Eliminierung. Darunter versteht mann die Abspaltung von Halogenatomen und Wasserstoffatomen, wobei ungesättigte Kohlenwasserstoffe (Alkene) entstehen.
Homologe Reihe der Alkane
Alkane mit gleichen Strukturmerkmalen, die sich jeweils um eine Gruppe unterscheiden, bilden eine homologe Reihe . Die ersten vier der Glieder der homologen Reihe der Alkane mit einer unverzweigten Kohlenstoffkette Methan , Ethan , Propan und Butan sind gasförmig, die nächsten Homologen sind flüssig und höhere Homologe fest.
Aufgrund ähnlicher struktureller Merkmale ergeben sich ähnliche Eigenschaften. Allerdings nimmt innerhalb der homologen Reihe auch die Kettenlänge der Alkane zu. Dadurch verändern sich die Kräfte innerhalb des Moleküls. Sie sind die Ursache für abgestufte Eigenschaften. Aus der Tabelle wird ersichtlich, dass die Schmelz- und Siedetemperaturen mit der Zunahme der Kettenlänge höher werden.
Verwendung von Alkanen
Ein erheblicher Teil der gewonnenen Alkane wird für die Energiefreisetzung genutzt. Erdgas, das zum größten Teil aus Methan besteht, wird als Heizgas in vielen Haushalten und in der Industrie eingesetzt. Propan und Butan sind als Flüssiggas bekannt.
Vergaserkraftstoff, Dieselkraftstoff und Heizöl, die bei der Erdölverarbeitung gewonnen werden, sind kompliziert zusammengesetzte Gemische, die neben Alkanen auch Cycloalkane und aromatische Kohlenwasserstoffe enthalten.
Allerdings werden Alkane auch als wichtige Ausgangsstoffe in der chemischen Industrie benötigt. In der Technik stellt man aus Methan und Wasserdampf das Synthesegas für die Methanol-Gewinnung her, ein Gasgemisch aus Wasserstoff und Kohlenstoffmonooxid. Methan ist Ausgangsstoff bei vielen wichtigen Synthesen, z. B. von Methylenchlorid, Methanol, Formaldehyd, Acetylen oder Blausäure.
Herstellung von Alkanen
Alkane kommen im Erdöl und im Erdgas vor und werden im Gemisch genutzt oder gezielt abgetrennt.
Sie können aber auch im Labor und in technischen Anlagen hergestellt werden. Das soll am Beispiel von Methan und Ethan gezeigt und erklärt werden.
Methan
Man kann Methan direkt aus den Elementen (Kohlenstoff und Wasserstoff) herstellen. Dies geschieht im elektrischen Lichtbogen zwischen zwei Kohleelektroden in einer Wasserstoffatmosphäre. Dabei entstehen Temperaturen von 1 200 °C (1 475 K).
Methan zerfällt allerdings bei Temperaturen oberhalb von 1 000 °C (1 275 K) relativ schnell wieder. Deshalb ist die Ausbeute an Methan auf diesem Wege sehr gering.
Methan ist Hauptbestandteil im Erdgas, es fällt auch bei den Crack- und Pyrolyseprozessen der Erdölverarbeitung an.
Methan entsteht ebenfalls bei der enzymatischen Verdauung von Cellulose unter anaeroben Bedingungen. Diese Reaktion wird beispielsweise in Biogasanlagen zur Verwertung von pflanzlichen Abfällen und tierischen Exkrementen genutzt. Sie läuft aber auch „ungenutzt“ im Verdauungstrakt von Rindern in großem Umfang ab. Da Methan ein Treibhausgas ist trägt auch die großangelegte Viehzucht in nicht unerheblichen Maße zur Verstärkung des vom Menschen verursachten (antropogenen) Treibhauseffekts bei.
Ethan
Ethan ist ebenfalls ein Bestandteil des Erdgases und wird zum großen Teil technisch aus Erdgas gewonnen. Es gibt aber auch andere Darstellungsmöglichkeiten.
Die sogenannte WURTZ-Synthese (oder WURTZ-Kupplung) aus dem Jahre 1855 beruht auf der Reaktion mit Iodmethan und Methylnatrium. Dabei nutzt man aus, dass der Kohlenstoff im Iodmethan durch das elektronegative Halogenatom teilweise positiviert ist, wohingegen der Kohlenstoff im Methylnatrium durch das elektropositive Metall teilweise negativiert ist. Dadurch lassen sich die beiden Methylgruppen zu Ethan koppeln.
Die WURTZ-Reaktion wird aber in erster Linie zur Darstellung höherer Homologer verwendet. Dazu setzt man dann das entsprechend längere Iodalkan (wahlweise auch Bromalkan oder Chloralkan) mit den gewünschten Metallalkylen um.
Propan ist das dritte Glied der homologen Reihe mit der Summenformel . Propan fällt bei den Crack- und Pyrolyseprozessen der Erdölverarbeitung mit an und wird daraus gewonnen. Es findet vielfältige Verwendung als Ausgangsstoff in der Petrolchemie, als Heizgas und Treibmittel für Aerosole.
Butane, Pentane und höhere Homologe
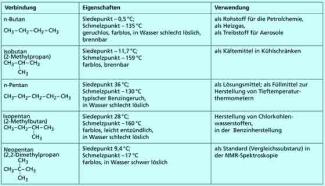
Für Butan existieren zwei isomere Verbindungen, die bei gleicher Summenformel verschiedene physikalische und chemische Eigenschaften aufweisen. Diese sind in einer abweichenden Struktur der Isomere begründet. Vom Pentan existieren drei Isomere. Bei höheren Homologen steigt die Zahl der Isomeren rasch an. So lassen sich theoretisch vom Dodecan bereits 355 Konstitutionsisomere (Strukturisomere) ableiten.
Höhere Alkane kommen in der Natur in der Schutzschicht von Äpfeln und Kohlblättern vor (27 bis 29 C-Atome). Auch Bienenwachs enthält hochmolekulare kettenförmige Alkane.
-
Isomere von Butan und Pentan mit ihren Eigenschaften