Alkene
Alkene sind Bestandteil des Erdgases bzw. Erdöls. Sie enthalten eine Doppelbindung im Molekül, d. h. zwischen zwei Kohlenstoffatomen im Molekül sind zwei gemeinsame Elektronenpaare ausgebildet. Alkene zählen daher zu den sogenannten „ungesättigten“ Kohlenwasserstoffen. Wegen dieser Doppelbindung sind sie im Vergleich zu den Alkanen sehr reaktiv, da die Doppelbindung leicht angegriffen werden kann und typische Reaktionen bedingt. Alkene bilden homologe Reihen.
Alkene (Olefine), ungesättigte Kohlenwasserstoffe
Die Alkene werden in der technischen oder älteren Literatur oft auch Olefine genannt. Die Bezeichnung rührt daher, dass Ethen mit Halogenen zu einer öligen, wasserunlöslichen Flüssigkeit, z.B. mit Brom zu 1,2-Dibromethan, reagiert (lat.: gaz olefinant = ölbildendes Gas).
Alkene gehören zu den Kohlenwasserstoffen, bestehen also nur aus den Elementen Kohlenstoff und Wasserstoff. Da die Alkene in ihren Molekülen zwischen zwei Kohlenstoffatomen eine Doppelbindung besitzen, haben sie generell zwei Wasserstoffatome weniger als die entsprechenden Alkane. Die Doppelbindung ist im Namen an der Endung -en erkennbar. Die allgemeine Formel der Alkene lautet . Alkene bilden genau wie die Alkane Isomere. Die Anzahl der möglichen Isomeren ist sogar noch größer als bei den Alkanen.
Hier gezeigt am Beispiel des Buten:
| Isomere des Buten | |
|
cis-But-2-en |
trans-But-2-en |
Isobuten (Methylpropen) |
Bedingt durch ihren Bau, weisen die Alkene typische Eigenschaften auf. Genau wie die Alkane sind sie schwer bzw. gar nicht in Wasser löslich.
Alkene sind brennbar. Da sie die Elemente Kohlenstoff und Wasserstoff enthalten, entstehen bei vollständiger Verbrennung Kohlenstoffdioxid und Wasser.
Additionsreaktionen
Besonders typisch für die Alkene sind jedoch Additionsreaktionen. Dabei werden Atome oder Atomgruppen an die Moleküle der Alkene angelagert. Aufgrund der Doppelbindung verläuft die Reaktion in typischer Art und Weise. An die Moleküle der Alkene können ganz unterschiedliche Atome angelagert werden. Handelt es sich um Wasserstoffatome, bezeichnet man diese spezielle Addition als Hydrierung. Dabei bilden sich als Reaktionsprodukte Alkane:
![]()
-
Ethen - ein gasförmiges Alken - entsteht u.a. auch in Früchten und fördert deren Reifung.

Bei den Alkenen können im Allgemeinen elektrophile sowie radikalische Additionen auftreten. Ein Beispiel für die elektrophile Addition an die C=C-Doppelbindung ist die Bromierung von Ethen. Über einen schrittweisen, über Zwischenstufen ablaufenden Prozess entsteht Dibromethan.
![]()
![]()
Diese Reaktion gilt gleichzeitig als Nachweis von Mehrfachbindungen. Sichtbares Merkmal dieser Reaktion ist die Entfärbung von Brom bzw. Bromwasser bei Normalbedingungen und ohne zusätzliche Energiezufuhr.
Eineradikalische Additionist zum Beispiel die Anlagerung von Bromwasserstoff an Propen bei Anwesenheit einer geringen Menge von Diacetylperoxid. Das Peroxid zerfällt zu einem freien Radikal und löst damit die folgende Kettenreaktion aus:
![]()
Polymerisation
Große Bedeutung in der chemischen Industrie hat die Polymerisation, ebenfalls eine spezielle Form der Additionsreaktion. Sie bildet die Grundlage für die Herstellung vieler Kunststoffe. Beispielsweise können sich Ethenmoleküle durch fortgesetzte Addition zu langen Molekülen vereinigen. Dabei bildet sich Polyethen (Polyethylen).
![]()
Nicht so typisch, aber möglich sind Substitutionsreaktionen und Eliminierungen.
Substitutionsreaktionenkönnen über die Bildung von Palladiumkomplexen erfolgen.![]()
Eliminierungsreaktionenkönnen zu Dreifachbindungen führen. Ein Beispiel hierfür ist die Umsetzung von 1,2-Dibromethen zu Bromethin.
Homologe Reihe der Alkene
Genauso, wie die anderen Kohlenwasserstoffe, bilden auch Alkene homologe Reihen. Meist betrachtet man die homologe Reihe der Alkene, die eine Doppelbindung zwischen den ersten beiden Kohlenstoffatomen aufweisen. Das erste Glied dieser Reihe ist der -Kohlenwasserstoff Ethen (Ethylen). Ethen, Propen (Propylen) und Buten sind gasförmig, höhere Homologe bis 15 Kohlenstoffatomen sind bei Raumtemperatur (25°C) flüssig, Alkene mit noch längerer Kohlenstoffkette sind fest.
| Name | vereinfachte Strukturformel | Summen-formel | Schmelz-tempe-ratur | Siede-tempe-ratur |
| Ethen | -169,5 °C | -103,9 °C | ||
| Propen | -185,2 °C | -47 °C | ||
| But-1-en | -190 °C | 6,1 °C | ||
| Pent-1-en | -138 °C | 30 °C | ||
| Hex-1-en | -98,5 °C | 63,5 °C | ||
| Oct-1-en | -104 °C | 123 °C |
Die Homologen weisen aufgrund ähnlicher Strukturmerkmale ähnliche Eigenschaften auf. Da die Kettenlänge innerhalb der homologen Reihe zunimmt, ergeben sich auch abgestufte Eigenschaften (siehe Tab.)
-
Ethen reagiert mit Brom
Herstellung der Alkene
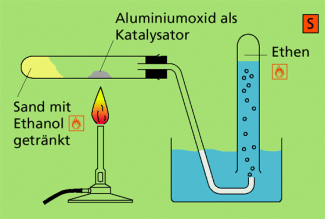
Obwohl die Alkene in den Rohstoffen der Erde (Erdöl, Erdgas) vorkommen, kann man sie auch im Labor herstellen. Dies soll nun am Beispiel des Ethens gezeigt werden.
Im Laboratorium lässt sich Ethen durch Erhitzen von Ethanol mit konzentrierter Schwefelsäure darstellen. Die Ursache dafür ist die stark wasserentziehende Wirkung von konzentrierter Schwefelsäure. Anstelle der konzentrierten Säure kann auch ein Katalysator eingesetzt werden. Aus dem Ethanol wird dadurch ein Molekül Wasser abgespalten und es entsteht eine Doppelbindung.
Die unterschiedlichen Reaktionsschritte kann man in einer Gesamtgleichung zusammenfassen.
In der Industrie gewinnt man Alkene allerdings durch thermisches Cracken aus dem Erdöl, bzw. dem Rohbenzin. Dabei werden unter Normaldruck bei ca. 1000°C (1275 K) die Molekülketten der höheren Alkane aus der Benzinfraktion in kleinere Stücke „gebrochen“ (gecrackt). Diesen Vorgang nennt man Pyrolyse.
oder
Aus Ethan entsteht dann bei diesen Bedingungen durch thermische Dehydrierung (Wasserabspaltung) Ethen.
-
Laborexperiment zur Darstellung von Ethen
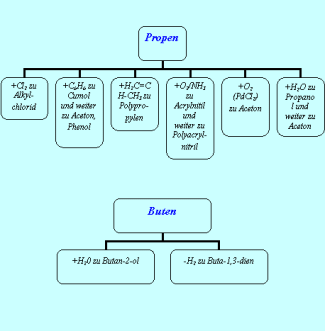
Verwendung von Alkenen
Ethen | Propen | Buten |
in der Lebensmittelindustrie zum Nachreifen von Obst, zur Herstellung von Kunststoffen, Klebstoffen, Lösungsmitteln, in der pharmazeutischen Industrie | als Brenngas (Flüssiggas), in der Benzinherstellung, zur Kunststoffherstellung | Kunststoff- und Synthesekautschuk-herstellung |
Alkene sind wertvolle Ausgangsstoffe für die chemische Industrie (Bild 4).
Wichtige Produkte aus niederen Alkenen
-
Industrielle Verwendung von Propen und Buten