Atombindung
Die Atombindung ist eine der drei chemischen Hauptbindungsarten, zu denen man auch die Ionenbindung und die Metallbindung zählt. Die Bindung zwischen den Atomen wird durch die Herausbildung eines oder mehrerer gemeinsamer Elektronenpaare bewirkt. Dadurch erreicht mindestens ein Atom eine stabile Elektronenkonfiguration, z. B. die sogenannte Achterschale. Je nachdem, wie stark das gemeinsame Elektronenpaar von einem der beiden Atome angezogen wird, unterscheidet man zwischen unpolaren und polaren Atombindungen.
Die Atombindung ist eine der drei chemischen Hauptbindungsarten, zu denen man auch die Ionenbindung und die Metallbindung zählt. Die Atombindung tritt bei Molekülen auf.
Stabilität bei Atomen
Atome streben einen energetisch stabilen Zustand an.
Dies wird durch eine voll besetzte Außenschale erreicht. Bei den Hauptgruppenelementen ist der stabile Zustand fast immer eine Achterschale.
Atome können zur Erreichung der Stabilität entweder Elektronen abgeben oder aufnehmen, also Ionen bilden oder mit anderen Atomen gemeinsame Elektronenpaare nutzen. Diese gemeinsamen Elektronenpaare bewirken die Bindungskräfte zwischen den Atomen.
Atome mit gleicher Elektronegativität ziehen die gemeinsamen Elektronenpaare auch gleich stark an. Eine unpolare Atombindung entsteht.
Besitzen die Atome unterschiedliche Elektronegativitäten, so werden die Elektronenpaare von dem Atom mit der größeren Elektronegativität stärker angezogen. Polare Atombindungen entstehen.
Allen Atomen, die im Periodensystem der Elemente zu der siebenten Hauptgruppe gehören, fehlt ein Elektron zur Erlangung einer abgeschlossenen Achterschale, auch Oktett genannt.
Sie können mit anderen Atomen ein gemeinsames Elektronenpaar bilden, sodass Moleküle entstehen.
Die entstehende Bindung wird als Elektronenpaarbindung (auch als Atombindung) bezeichnet.
Atome können ein gemeinsames Elektronenpaar nutzen, wenn ihnen nur noch ein Elektron zur Stabilität fehlt. Es können aber auch mehrere gemeinsame Elektronenpaare genutzt werden.
-
Atombindungsarten
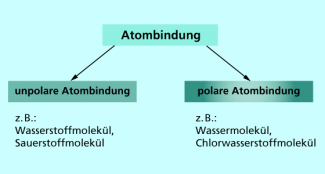
Moleküle mit einer Elektronenpaarbindung: Halogene
1. Mit Atomen des gleichen Elementes bilden sich unpolare Atombindungen aus, z.B. im Chlormolekül.
Zwei Chloratome nutzen gemeinsam und aufgrund ihrer gleichen Elektronegativitätswerte auch gleichberechtigt ein Elektronenpaar, wobei jedes Chloratom ein Elektron beisteuert.
-
Chlormolekül
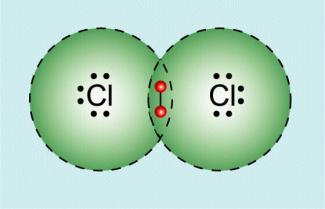
2. Mit Atomen anderer Elemente bilden sich polare Atombindungen aus, z.B. im Chlorwasserstoffmolekül.
Das Chloratom und das Wasserstoffatom nutzen das gemeinsame Elektronenpaar aus dem Elektron des Wasserstoffatoms und einem Elektron des Chloratoms.
Chlor hat aber eine höhere Elektronegativität als Wasserstoff und zieht das Elektronenpaar stärker an. Es ist in Richtung Chlor verschoben. Die Atombindung ist polar.
-
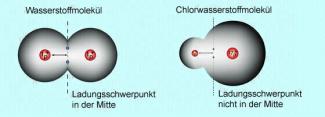
Vergleich Wasserstoffmolekül und Chlorwasserstoffmolekül
Moleküle mit mehreren Elektronenpaarbindungen:
Sauerstoff
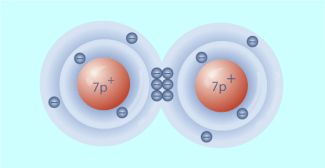
Das Sauerstoffatom besitzt sechs Außenelektronen. Um eine abgeschlossene Achterschale zu erreichen, muss es noch zwei Elektronen aufnehmen. So entsteht ein Sauerstoff-Ion O2−.
Wenn zwei Sauerstoffatome hingegen untereinander zwei gemeinsame Elektronenpaare für die Atombidung nutzen, erreichen beider wiederum eine abgeschlossene Schale. Da die Bindung hier von zwei Elektronenpaaren bewirkt wird, spricht man auch von einer Doppelbindung.
-
Die Atombindungen im Molekül sind unpolar.
Mit Atomen anderer Elemente, z.B. mit Wasserstoff bildet Sauerstoff ebenfalls zwei Atombindungen aus, zu jedem Wasserstoffatom eine.
Diese bindenden Elektronenpaare sind jedoch in Richtung des Sauerstoffatoms verschoben, da Sauerstoff eine höhere Elektronegativität besitzt. Polare Atombindungen sind entstanden.

