Atommodelle
Atommodelle sind alle Vorstellungen über den Aufbau der Atome, insbesondere über die Struktur der Atomhülle. Historisch bedeutsame und sehr anschauliche Atommodelle sind das rutherfordsche Atommodell und das bohrsche Atommodell. Moderne Atommodelle sind dagegen sehr komplex und müssen mit mathematischen Funktionen beschrieben werden.
Entwicklung der Vorstellungen vom Aufbau des Atoms
Bereits in der Antike gab es Vorstellungen darüber, dass die Stoffe aus sehr kleinen Teilchen bestehen könnten. Diese kleinen Teilchen wurden Atome genannt (atomos bedeutet im Griechischen das Unteilbare). Sie sollten in der Qualität gleich sein, aber in Form und Gewicht verschieden. Ein Vertreter dieser Auffassung war der griechische Philosoph DEMOKRIT (5 Jh. v. Chr.). Diese Hypothese konnte jedoch nicht experimentell bestätigt werden.
Im Laufe der Jahrhunderte geriet die Vorstellung von den Atomen als unteilbare Einheiten der Stoffe in Vergessenheit.
Erst im 17. und 18. Jahrhundert wurden mit der Entwicklung der Wärmlehre diese Ideen wieder aufgegriffen, ohne dass die Existenz von kleinsten Teilchen nachgewiesen werden konnte. Dies gelang erst zu Beginn des 20. Jahrhunderts.
Im Laufe des 19. Jahrhundert gab es eine ganze Reihe von experimentellen Ergebnissen, die auf die Existenz kleinster Teilchen hindeuteten. JOHN DALTON (1766-1844) kam auf der Grundlage des Gesetzes von der Erhaltung der Masse und der Gesetze von den konstanten Massenverhältnissen 1808 zu seiner Atomhypothese:
- Alle Atome desselben Elementes sind untereinander gleich.
- Atome verschiedener Elemente haben unterschiedliche Massen.
In den siebziger und achtziger Jahren des 19. Jahrhundert haben viele Physiker mit Katodenstrahlen experimentiert und festgestellt, dass sich diese Strahlen in elektrischen und magnetischen Feldern ablenken lassen. Der deutsche Physiker EMIL WIECHERT (1861-1928) und unabhängig davon der englische Physiker JOSEPH JOHN THOMSON (1856-1940) fanden in den neunziger Jahren des 19. Jahrhunderts heraus, dass Katodenstrahlen aus sehr kleinen Teilchen mit negativer Ladung bestehen müssten. Als Name für dieses erste Elementarteilchen wurde 1897 von dem irischen Physiker GEORGE FRANCIS FITZGERALD (1851-1901) der Begriff Elektron eingeführt, der einige Jahre vorher schon für die elektrische Elementarladung vorgeschlagen worden war. Die Katodenstrahlen erwiesen sich als schnell bewegte Elektronen, als Elektronenstrahlen.
Weitere Entdeckungen führten immer stärker zu der Frage nach den elementaren Bausteinen der Stoffe. So hatte
HENRI BECQUEREL (1852-1908) 1896 eine neue Art von Strahlung entdeckt, die dann von MARIE und PIERRE CURIE genauer untersucht wurde und die wir heute als radioaktive Strahlung kennen. Auch diese Art der Strahlung hatte offensichtlich mit atomaren Vorgängen zu tun.
Die Suche nach geeigneten Atommodellen, mit denen die experimentellen Ergebnisse erklärt werden konnten, begann.
Das rutherfordsche Atommodell
1909/10 führte der englische Physiker ERNEST RUTHERFORD (1871-1937) mit seinen Mitarbeitern Versuche zum Durchgang von Alpha-Strahlung durch dünnen Metallfolien durch. Der größte Teil der Strahlung ging hindurch, ein kleiner Teil wurde jedoch abgelenkt. Bereits vorher hatte man festgestellt, dass Katodenstrahlen, also schnell bewegte Elektronen, dünne Metallfolien durchdringen können. RUTHERFORD zog daraus den Schluss, dass der größte Teil des Atoms „leer“ bzw. masselos ist und entwickelte das rutherfordsche Atommodell , das dem Aufbau des Planetensystems ähnelt und deshalb auch als Planetenmodell bezeichnet wird: Um einen positiv geladenen Kern, in dem die Masse des Atoms konzentriert ist, bewegen sich die Elektronen auf elliptischen Bahnen. RUTHERFORD konnte aber nicht erklären, warum die Atome stabile Teilchen darstellen und die negativen Elektronen nicht in den positiven Kern stürzen. Auch die Tatsache, dass sich die Elektronen in der Hülle auf unterschiedlichen Bahnen bewegen, wurde erst später erkannt.
-
rutherfordsches Atommodell
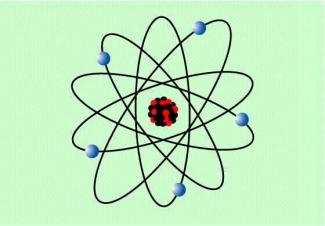
Das bohrsche Atommodell
Der dänische Physiker NIELS BOHR (1885-1962) brach 1913 radikal mit einigen Vorstellungen der klassischen Physik und stellte ein anderes Atommodell vor, das heute als bohrsches Atommodell bezeichnet wird: Die Elektronen bewegen sich auf bestimmten Bahnen (Schalen) um den Atomkern. Der jeweiligen Bahn kann eine bestimmte Energie (ein Energieniveau) zugeordnet werden. Wenn Energie zugeführt wird, können Elektronen auf eine kernfernere Bahn springen. Beim Zurückspringen wird diese Energie wieder frei und in Form von Strahlung, z. B. als Licht oder als Röntgenstrahlung, abgegeben. Nach dem Aussehen wird dieses Schalenmodell auch „Schießscheibenmodell“ genannt. Es erklärt den grundlegenden Aufbau des Periodensystems, da jede Schale nur eine bestimmte Anzahl von Elektronen aufnehmen kann. Der Radius der Elektronenbahnen bestimmt nach BOHR die Größe der Atome.
Das bohrsche Atommodell wurde von ARNOLD SOMMERFELD (1868-1951) mithilfe eines Quantenansatzes der Atomhülle durch den Übergang zu Ellipsenbahnen der Elektronen weiterentwickelt. Damit konnte SOMMERFELD die Feinstruktur von Atomspektren und die Röntgenlinien verschiedener Elemente erklären.
Die weitere Entwicklung
In der Folgezeit wurden die ersten wissenschaftlichen Atommodelle immer weiter verfeinert und immer komplexer. 1932 entdeckte der englische Physiker JAMES CHADWICK (1891-1974) das Neutron.
Noch gravierender waren die Erkenntnisse zur Struktur der Elektronenhülle: Mit der Entwicklung der Quantenphysik setzte sich die Überzeugung durch, dass man Atome prinzipiell nicht über eine Teilchenvorstellung und damit anschaulich deuten kann, sondern sich Atome nur mit komplexen mathematischen Modellen beschreiben lassen. Für ein Elektron in der Atomhülle kann man nie genau angeben, wo es sich zu einem bestimmten Zeitpunkt befindet. Angegeben werden kann nur eine bestimmte Wahrscheinlichkeit für einen Bereich, in dem es sich aufhält.
Einen solchen Bereich, in dem die Aufenthaltswahrscheinlichkeit für ein Elektron 90 % beträgt, bezeichnet man als Orbital, das entsprechende Atommodell als Orbitalmodell bzw. wellenmechanisches Atommodell verwendet. Dabei wird die Bewegung eines Elektrons als Wellenfunktion beschrieben.
Diese Modelle sind grafisch nur schwer darstellbar und phänomenologisch wenig anschaulich. Einige Informationen dazu sind unter den Stichworten Quantenzahlen, Orbitale und quantenmechanisches Atommodell zu finden.
-
Nach dem bohrschen Atommodell kreisen die Elektronen auf verschiedenen Bahnen um den Kern.
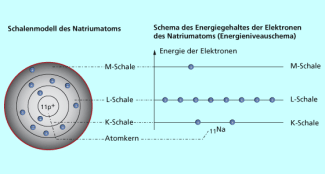
Suche nach passenden Schlagwörtern
- Orbitalmodell
- Wilhelm Conrad Röntgen
- John Dalton
- Orbitale
- SOMMERFELD
- Elektron
- brownsche Bewegung
- DALTON
- Modell
- bohrsches Atommodell
- Becquerell
- wellenmechanisches Atommodell
- Außenelektronen
- Atommodell
- Atombau
- Schießscheibenmodell
- Radioaktive Strahlung
- Atom
- Thomson
- Robert Brown
- Niels Bohr
- Albert Einstein
- rutherfordsches Atommodell
- Atomkern
- Atome
- Rosinenmodell
- Ernest Rutherford
- DEMOKRIT
- Elementarteilchen
- Kelvin
- Atommodelle
- Planetenmodell
- Elektrische Ladung

