Carbonsäuren
Die Carbonsäuren weisen sehr unterschiedliche Strukturen auf, da es sich um Derivate der entsprechenden Kohlenwasserstoffe handelt. Die bekanntesten Vertreter sind sicherlich die Alkansäuren, aber auch ungesättigte Carbonsäuren oder aromatische Verbindungen gehören dazu. Das gemeinsame Strukturmerkmal besteht in der Carboxylgruppe, die bei allen Carbonsäuren die Eigenschaften mit beeinflusst.
Organische Säuren sind als natürlicher Bestandteil von Lebensmitteln für deren stark säuerlichen Geschmack verantwortlich. Sie spielen in der Natur aber auch bei Stoffwechselvorgängen als Zwischen- oder Endprodukte eine große Rolle.
Die Carbonsäuren sind durch eine besondere funktionelle Gruppe gekennzeichnet - die Carboxylgruppe.
![]()
Bei den Carbonsäuren handelt es sich um Derivate von Kohlenwasserstoffen. Da die Kohlenwasserstoffe kettenförmig, verzweigt oder unverzweigt, ringförmig oder aromatisch und außerdem gesättigt bzw. ungesättigt sein können, ist auch bei den Carbonsäuren eine Vielfalt an Strukturen möglich. Hinzu kommt, dass diese organischen Säuren eine Carboxylgruppe (Monocarbonsäuren), aber auch mehrere Carboxylgruppen (Dicarbonsäuren, Tricarbonsäuren usw.) in ihren Molekülen aufweisen können. Die Vielfalt der Carbonsäuren ist also sehr groß.
Die einfachsten Vertreter dieser Gruppe sind die Alkansäuren. Sie lassen sich von den Alkanen ableiten und besitzen eine Carboxylgruppe im Molekül. Somit gehören sie also zu den kettenförmigen, gesättigten Monocarbonsäuren. Wichtige Vertreter sind die Methansäure (Ameisensäure) und die Ethansäure (Essigsäure). Besonders langkettige Vertreter der Alkansäuren zählen zu den sogenannten Fettsäuren.
Fettsäuren
Eine Reihe von Carbonsäuren sind am Aufbau der Fette und der fetten Öle beteiligt. Sie werden als Fettsäuren bezeichnet. Wichtige Fettsäuren sind in einer Tabelle zusammengestellt. Im Alkylrest der gesättigten Fettsäuren existieren zwischen den Kohlenstoffatomen nur Einfachbindungen. Dabei bildet Butansäure eine Ausnahme, weil sie als einzige kurzkettige Säure ebenfalls an der Bildung von Fetten beteiligt ist.
Die ungesättigten Fettsäuren enthalten in der Kohlenstoffkette eine (einfach ungesättigt) oder mehrere Doppelbindungen (mehrfach ungesättigt), z.B. Octadecatriensäure. Alle Fettsäuren sind für die Ernährung von Bedeutung. Besonders trifft das auf die Fettsäuren zu, die der menschliche Körper nicht selbst aufbauen kann. Er muss sie, wie die Vitamine, mit der Nahrung aufnehmen. Solche Fettsäuren nennt man essenzielle Fettsäuren (unentbehrliche Fettsäuren). Dabei handelt es sich besonders um die ungesättigten Fettsäuren. Fehlen diese Fettsäuren, so treten Mangelerscheinungen beim Menschen auf.
Pflanzliche Fette bzw. fette Öle sind besonders reich an essenziellen Fettsäuren. Sie sollten in der Nahrung ausreichend vorhanden sein.
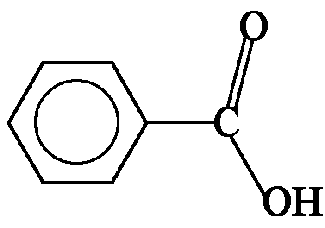
Benzoesäure
Benzoesäure ist ein Derivat des Benzens. Es handelt sich um die einfachste aromatische Carbonsäure. Sie ist auch unter der alten Bezeichnung Benzolkarbonsäure bekannt.
In freiem Zustand kommt Benzoesäure in Balsamen und Harzen vor, wie in Benzoeharz, aber auch in Beeren, wie Preisel-, Him- und Heidelbeeren. Außerdem ist Benzosäure häufig in Estern chemisch gebunden, die auch in Alkaloiden enthalten sind. In Früchten, Rinden, Blüten und Blättern vieler Pflanzen bilden Benzoesäurereste mit anderen Gruppen Amide.
Benzoesäure entsteht u. a bei der Oxidation von Benzaldehyd
. Technisch herstellen kann man sie auch durch die Oxidation von Toluen .
Sie dient als Zwischenprodukt für Benzoesäureester in Weichmachern und Riechstoffen, für Phenol-, Epoxid- und Alkyd-Harze, für Benzoylchlorid und Benzonitril .
Aufgrund der antimikrobiellen Eigenschaften wird Benzoesäure auch als Konservierungsmittel verwendet. Sie ist als solches für saure Lebensmittel unter der Nummer E 210 zugelassen. Außerdem wird sie zum Frischhalten von Klebstoffen, Seifen und Tabak eingesetzt.
Dicarbonsäuren
Die Dicarbonsäuren besitzen im einfachsten Falle an beiden Enden der Kohlenstoffkette je eine Carboxylgruppe. Es handelt sich also um zweiwertige organische Säuren mit der allgemeinen Summenformel: . Ihren Namen erhalten sie entweder nach den IUPAC-Regeln (dann meist „-disäure“ oder „-dicarbonsäure“) oder durch in der Chemie häufig verwendete Trivialnamen.
Beispiel.:
vereinfachte Strukturformel:
Trivialname: Sebacinsäure
chemische Namen: Decandisäure oder Octandicarbonsäure
Beide chemische Bezeichnungen sind richtig. Der Unterschied zwischen den chemischen Namen mit den Enden „-disäure“ und „-dicarbonsäure“ liegt in der Einbeziehung der Kohlenstoffatome, die zur Carboxylgruppe gehören.
Es gibt auch aromatische Dicarbonsäuren, wie z. B. die Phthalsäure.
|
Trivialname |
IUPAC-Name |
vereinfachte Strukturformel |
| Oxalsäure | Ethandisäure | |
| Malonsäure | Propandisäure | |
| Bernsteinsäure | Butandisäure | |
| Adipinsäure | Hexandisäure | |
| Phthalsäure | Benzen-1,2-dicarbonsäure |
-
Benzoesäure
Oxalsäure (Kleesäure)
Der fachsystematisch korrekte Name lautet Ethandisäure
(HOOC-COOH).
Die Oxalsäure ist die einfachste kettenförmige Dicarbonsäure. Aus dem wässrigen Medium kristallisiert sie in Form von farblosen Prismen aus. Sie löst sich sehr gut in warmem Wasser und Ethanol, dagegen schwer in Chloroform, Ether und Benzen.
Die Oxalsäure ist eine der weitverbreitetsten Pflanzensäuren. Sie kommt im Sauerklee, Rhabarber und Sauerampfer in höheren Konzentrationen vor allem als Kaliumsalz (Kaliumoxalat - KOOC-COOK) vor. Der Verzehr dieser Produkte ist in größeren Mengen kritisch. Die Folge sind Durchfall, Erbrechen, Krämpfe, Nierenschäden, Koma und schließlich Tod (infolge eines Kreislaufkollaps). Die gefährliche Menge liegt bereits zwischen 5 und 10 g. Die Wirkung beruht auf der Ausfällung von Calciumoxalat, das in der Niere die Nierenkanälchen verstopft und über die Hälfte aller Nierensteine ausmacht.
Oxalsäure wird in der chemischen Analytik verwendet. Sie dient in der Industrie als Bleichmittel, Fleckenmittel (z. B. Rost und Tinte), als Farbstoffbestandteil und zur Herstellung von manchen Kunstharzen.
Bernsteinsäure
Der chemische Name der Bernsteinsäure lautet Butandisäure ().
Die Bernsteinsäure hat in der Natur große Bedeutung. Sie tritt als natürlicher Bestandteil des Citratcyklus (Citronensäurecyclus - Zellatmung) auf. Weiterhin kommt sie in vielen Gemüsen, Früchten, Braunkohle, Pilzen und Rinden vor.
In der chemischen Industrie wird sie zur Herstellung von Harzen, Lösungsmitteln, Weichmachern und Geschmacksstoffen benötigt.
Adipinsäure
Der chemische Name der Adipinsäure ist Hexandisäure HOOC-(CH2)4-COOH. Die Adipinsäure hat große technische Bedeutung für die Herstellung von Polyamiden. Die Synthesefaser Nylon® (Du Pont) ist ein Polyamid aus Adipinsäure und Hexamethylendiamin NH2-(CH2)6-NH2.
Phthalsäure und Terephthalsäure
Der chemische Name der Phthalsäure lautet 1,2-Benzen-dicarbonsäure (). Die isomere 1,4-Benzen-dicarbonsäure hat den Trivialnamen Terephthalsäure.
Genau wie bei der Benzoesäure handelt es sich um ein Derivat des Benzens und damit um eine aromatische Verbindung.
Die Phthalsäuren werden in der Industrie zur Herstellung von Kunstharzen, Farbstoffen und ihren Derivaten (z. B. Phthalsäureester) verwendet.
Aus Terephthalsäure und Ethandiol erhält man Polyester (PET), die sowohl als Textilfasern als auch als Kunststoffe, z. B. für Getränkeflaschen, genutzt werden.

