Chloride
Chloride sind die Salze der Chlorwasserstoffsäure (Salzsäure). Sie bestehen aus positiv geladenen Metall- oder Ammonium-Ionen und negativ geladenen Chlorid-Ionen. Chloride sind meist in Wasser sehr gut löslich. Der Nachweis von Chlorid-Ionen kann durch eine Fällungsreaktion mit Silbernitratlösung erfolgen.
In wässriger Lösung dissoziiert Chlorwasserstoff in Wasserstoff-Ionen (Hydronium-Ionen) und Chlorid-Ionen. Die wässrige Lösung wird Chlorwasserstoffsäure oder Salzsäure genannt.
Chloride sind die Salze der Chlorwasserstoffsäure (Salzsäure). Sie bestehen aus positiv geladenen Metall- oder Ammonium-Ionen und negativ geladenen Chlorid-Ionen.
Chloride können durch eine Redoxreaktion der Chlorwasserstoffsäure mit unedlen Metallen entstehen.
Reaktion von Chlorwasserstoffsäure mit Magnesium
Chloride bilden sich auch durch Reaktion von Chlorwasserstoffsäure mit Metalloxiden oder durch Neutralisationsreaktion mit Metallhydroxiden.
Eigenschaften der Chloride
Chloride sind meist in Wasser sehr gut löslich, dabei entstehen starke Elektrolyte. Sie dissoziieren in Metall-Ionen (oder Ammonium- Ionen) und Chlorid-Ionen.
Dissoziation von Magnesiumchlorid
Wichtige Chloride sind Natriumchlorid und Kaliumchlorid.
Für die Herstellung von Chloriden gibt es zahlreiche Methoden. Wichtige Herstellungsverfahren von anorganischen Chloriden sind die folgenden Reaktionen zwischen:
- Elementen, z.B. Alkalimetall, und Chlor,
- Element und Chlorwasserstoffsäure,
- Metalloxid, Kohlenstoff und Chlor,
- Hydroxid und Chlorwasserstoffsäure,
- Carbonat und Chlorwasserstoffsäure.
Nachweis des Chlorid-Ions
Der Nachweis von Chlorid-Ionen kann durch eine Fällungsreaktion erfolgen.
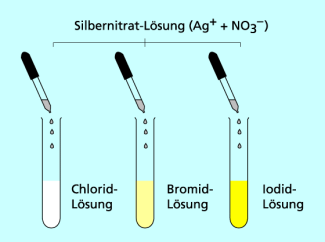
Durch Zugabe von Silbernitratlösung zu einer chloridhaltigen Lösung können die Chlorid-Ionen nachgewiesen werden. Silber-Ionen reagieren mit Chlorid-Ionen, es entsteht das fast unlösliche, weiße Silberchlorid, das aus der Lösung ausfällt.
Auch Bromid-Ionen und Iodid-Ionen können mit Silbernitratlösung nachgewiesen werden. Nur ist der Niederschlag blassgelb bzw. sattgelb.
Vorkommen und Verwendung
Chloride kommen auch in der Natur in großen Lagerstätten vor, z.B. Natriumchlorid als Steinsalz oder Kaliumchlorid als Sylvin.
Der größte Anteil der Chloride kommt gelöst im Meerwasser und in großen unterirdischen Salzlagern vor, die durch das Verdunsten des Wassers urzeitlicher Weltmeere entstanden sind. Diese Vorkommen sind die Basis für die Gewinnung oder die bergmännische Förderung von verschiedenen Chloriden.
Durch Abtrennen von Meerwasser im größeren Becken an der Küste gewinnt man besonders in Ländern mit starker Sonneneinstrahlung die Salze durch Verdunstung des Wassers. Die weitaus größte Menge von Salzen wird bergmännisch gefördert.
Natriumchlorid aus solchen Förderstätten wird als Steinsalz bezeichnet. Es ist in feinkristallinem Zustand unser Kochsalz. Nur ein geringer Teil des gewonnenen Steinsalzes ist Würzmittel für unsere Speisen, ein großer Teil wird als Konservierungmittel für Fisch- und Fleischwaren verwendet.
In der chemischen Industrie wird Natriumchlorid als Ausgangsstoff für viele Chemikalien und Produkte, z.B. Salzsäure, Natronlauge, Chlor, Soda, Enthärter, Abbeize, PVC u.a., eingesetzt.
-
Nachweis von Halogenid-Ionen
Kaliumchlorid dient hauptsächlich als Ausgangsstoff für mineralische Düngemittel, die Kalium-Ionen enthalten. Kalium ist ein Hauptnährstoff für die Pflanzen. Ebenso wie Natriumchlorid wird Kaliumchlorid als chemischer Rohstoff genutzt.
Magnesiumchlorid wird für die Herstellung des Leichtmetalls Magnesium benötigt. Es wird in geringer Menge im Labor eingesetzt, den größten Teil benötigt man jedoch als Legierungsbestandteil für Konstruktionsmetalle.
Zinkchlorid wird in Form einer Lösung als Elektrolyt für Zink-Kohle-Batterien genutzt.
-
Natriumchlorid ist ein Kristall.

Boris Mahler, Berlin

