elektrochemische Reaktion
Bei der chemischen Gewinnung von Elektrizität und dem Einsatz von Elektrizität bei chemischen Prozessen spielen elektrochemische Reaktionen eine entscheidende Rolle.
Bei diesen Prozessen sind Reduktions- und Oxidationsvorgänge kombiniert.Als Anode wird die Elektrode bezeichnet, an der die Oxidation stattfindet. Die Katode ist die Elektrode an der die Reduktion erfolgt.
Elektrochemische Reaktionen
Bei den freiwillig ablaufenden elektrochemischen Prozessen wird chemische Energie in elektrische Energie umgewandelt. Diese elektrochemischen Reaktionen werden als galvanische Prozesse bezeichnet.
Wird eine äußere Spannung angelegt, so ist es möglich die dem galvanischen Prozess zu Grunde liegende Reaktion umzukehren. Diese elektrochemischen Prozesse werden als Elektrolysen
bezeichnet.
Halbzellen, Spannungsreihe
Systeme die ein Metall und eine wässrige Lösung eines ihrer Salze enthalten werden als Halbelemente (Halbzellen) bezeichnet.
Werden zwei dieser Halbzellen leitend über einen Stromverbraucher miteinander verbunden, so kann die elektrische Energie der Zelle genutzt werden.
Cu + Fe → Cu + Fe
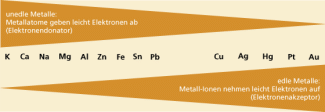
Je nach Art des Metalls ist das Bestreben in Lösung zu gehen groß (unedle Metalle, negatives Potenzial) oder weniger groß (edle Metalle, positives Potenzial).
Werden die Metalle nach ihren Potenzialen geordnet, so stellt diese Reihung eine elektrochemische Spannungsreihe dar. Das Potenzial des Vorganges H + e → ½ H wird dabei als Bezugsgröße willkürlich Null Volt gesetzt.
Wird ein unedles Metall in die wässrige Lösung eines edleren, rechts von ihm in der Spannungsreihen stehenden Metalls getaucht, so scheidet sich das edlere Metall ab, das unedlere Metall geht in Lösung.
Daraus folgt: taucht man einen Eisennagel in eine wässrige Lösung von Kupfer(II)-sulfat, überzieht sich der Nagel nach einer Weile mit einer kupferfarbenen Schicht.
Die kupferfarbene Schicht zeigt an, dass sich auf dem Eisennagel elementares Kupfer (Cu) abscheidet. Dazu müssen die zweifach positiv geladenen Kupfer-Ionen der Kupfer(II)- sulfatlösung zwei Elektronen aufgenommen haben (Reduktion).
Elektronenaufnahme (Reduktion):
![]()
Elektronenabgabe (Oxidation):
![]()
Die Eisenatome geben in dieser Reaktion Elektronen ab, sobald sie mit Kupfer-Ionen in Kontakt kommen.
![]()
Taucht man umgekehrt einen Kupferstab in eine Eisensulfatlösung, findet keine Reaktion statt.
![]()
Die Ursache dafür liegt in der Oxidierbarkeit der Metalle. Kupfer ist edler als Eisen und damit nicht so leicht zu oxidieren. Das Eisen gibt leichter Elektronen ab und wird damit einfacher oxidiert als das Kupfer. Das Bestreben der Kupferatome, Elektronen abzugeben, ist im Verhältnis zu Eisenatomen geringer. Kupferatome geben daher keine Elektronen an Eisen-Ionen ab.
Taucht man dagegen einen Kupferstab in eine Silbernitratlösung, scheidet sich Silber ab.
![]()
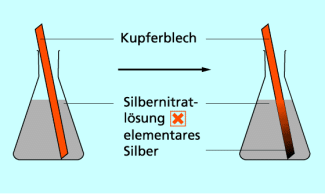
Es erfolgt jedoch keine Reaktion, wenn ein Silberstab in eine Kupfersulfatlösung eintaucht. Silber ist edler als Kupfer. Daher vollzieht sich kein Elektronenübergang zwischen Silberatomen und Kupfer-Ionen.
![]()
-
Zwischen Silber-Ionen und Kupferatomen erfolgt ein Elektronenübergang.
Die Metalle Silber, Kupfer und Eisen können aufgrund dieser Reaktionen mit den Metallsalzlösungen geordnet werden. Silberatome haben von den genannten Metallen das geringste, Eisenatome das größte Bestreben, Elektronen abzugeben.
Durch weitere Versuche mit anderen Metallen und ihren Salzlösungen ist es möglich, die Reihe zu erweitern. Es ergibt sich die bereits oben erwähnte Redoxreihe (elektrochemische Spannungsreihe ) der Metalle.
Zu einer Redoxreaktion zwischen Metallatomen und Metall-Ionen kommt es immer dann, wenn ein Metallatom mit einem in der Redoxreihe rechts von ihm stehenden Metall-Ion in Kontakt kommt. Dabei gehen die Elektronen immer von den Atomen des unedleren Metalls auf die Ionen des edleren Metalls über. Dieser Übergang der Elektronen bildet die Grundlage für die Stromerzeugung in Batterien.
Galvanische Zellen, Primärelemente
Galvanische Zellen dienen der Erzeugung elektrischer Energie. Sie werden auch als Primärzellen oder Batterien bezeichnet.
Bekannte Primärzellen sind das Daniell – Element und
das Leclanché- Element.
Daniell - Element
Bei dem von J. F. DANIELL im Jahr 1836 entwickelten Element sind zwei Halbzellen vorhanden, die zu einer galvanischen Zelle zusammengeschalten werden:
Halbzelle 1: Kupferblech in einer wässrigen CuSO – Lösung,
Halbzelle 2: Zinkblech in einer wässrigen ZnSO – Lösung.
Es laufen folgende Reduktions-Oxidations-Reaktionen ab:
Katode: Cu + 2e → Cu
Anode: Zn → Zn + 2e
Werden die beiden Halbzellen leitend verbunden, so lässt sich eine Zellspannung von 1,1 Volt messen.
Gesamtreaktion: Cu + Zn → Cu + Zn
Leclanché - Element
Die sogenannte Zink – Kohle – Batterie wurde um 1870 vom französischen Chemiker GEORGES LECLANCHÉ(1839 – 1882) entwickelt.
Die Katode ist ein Grafitstab, der von Braunstein (MnO) umgeben ist. Die Anode besteht aus einem Zinkbecher. Als Elektrolyt dient eine konzentrierte wässrige Ammoniumchlorid – Lösung (NHCl).
Die Gesamtreaktion kann durch die Gleichung beschrieben werden:
Zn + 2 NH + 2 MnO → MnO + [Zn(NH)] + HO
Moderne Batterien sind die Zink – Silberoxid – Batterie und die Lithium-Zellen.
Sekundärelemente, Akkumulatoren
Als Sekundärelemente werden solche Energiequellen bezeichnet, bei denen nach Ablauf der Entladung, durch Anlegen einer äußeren Spannung, der chemische Vorgang des Entladens umgekehrt und danach der Entladevor-gang wiederholt werden kann. Solche Zellen werden als Akkumulatoren bezeichnet. Der bekannteste Akkumu-lator ist der Bleiakkumulator.
Bleiakkumulator
Beim Bleiakkumulator kann der Zyklus Entladen – Laden mehrere hundert mal wiederholt werden.
Der zu Grunde liegende chemische Vorgang ist:
Da beim Entladen Wasser gebildet wird, kann der Ladezustand des Akkumulators durch Bestimmung der Dichte des Elektrolyten Schwefelsäure bestimmt werden.
Moderne Akkumulatoren sind der Nickel-Cadmium- und der Nickel-Metallhydrid-Akkumulator sowie der Lithium-Ionen-Akkumulator.
In elektrochemischen Brennstoffzellen wird aus Wasserstoff und Sauerstoff direkt elektrische Energie gewonnen. Es erfolgt keine Verbrennung unter Abgabe von thermischer Energie, sondern an einem geeigneten Substrat erfolgt die Reaktion der Gase zu Wasser unter Bildung von elektrischer Energie.
Elektrolyse
Durch Elektrolyse können nicht freiwillig ablaufende chemische Prozesse erzwungen werden. Galvanische Prozesse werden umgekehrt. Die anzulegende Spannung wird als Zersetzungsspannung bezeichnet.
Durch Elektrolyse werden Metalle aus wässrigen Lösungen (Kupfer, Silber) oder aus Metallschmelzen (Natrium, Aluminium) abgeschieden.
Na + e → Na
Cu + 2 e → Cu
Al + 3 e → Al
Elektrolyseprozesse spielen in Labor und Technik eine große Rolle.
- Synthese von Elementen (Na, Al, Cu, Cl, H, O, F)
- Reinigungen (Elektroraffination) von Metallen (Cu, Cr, Ni)
- Elektrochemische Analysenverfahren (Elektrogravimetrie)
- Korrosionsschutz, Galvanisieren (Verchromen, Vernickeln)
- Energiespeicherung (Akkumulatoren)
Die Stoffmenge n der an den Elektroden abgeschiedenen Substanzen ist proportional der aufgewandten Strommenge Q. Dieser Zusammenhang wurde von M. FARADAY (faradaysche Gesetze) entdeckt.
-
Redoxreihe