Elektrolyse
Die beim Stromdurchgang durch einen Elektrolyten hervorgerufenen chemischen Veränderungen werden als Elektrolyse bezeichnet. Es erfolgt die direkte Umwandlung elektrischer Energie in chemische Energie.
In leitenden Flüssigkeiten können elektrische Ströme fließen. Solche Flüssigkeiten sind Elektrolyte. Die chemische Zersetzung dieser Elektrolyten durch den Stromfluss bezeichnet man als Elektrolyse.
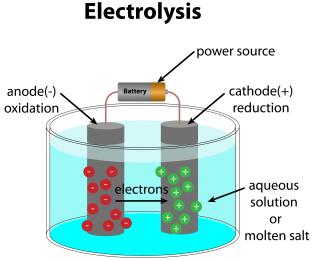
Fließt durch einen Elektrolyten ein Gleichstrom, so wirkt die in den Elektrolyten eintauchende Katode als Elektronendonator. Die Anode der Elektrolysezelle wirkt als Elektronenakzeptor.
An den Elektroden laufen Reduktions - Oxidations - Prozesse ab. Man spricht von anodischer Oxidation und katodischer Reduktion.
Um eine Vermischung der an der Anode entstehenden Produkte mit den an der Katode gebildeten Produkten zu vermeiden, werden auch Diaphragmen eingesetzt. Diese Materialien sind zwar stromdurchlässig, aber nicht durchlässig für die Anoden- bzw. Katodenprodukte.
Der Vorgang der Elektrolyse wurde 1800 von RITTER entdeckt. Von DAVY, FARADAY und ARRHENIUS wurden Theorie und Praxis der Elektrolyse weiterentwickelt.
Elektrolysen können in geeigneten Lösemitteln oder in der Schmelze durchgeführt werden.
Beim Stromdurchgang führt der ohmsche Widerstand des Elektrolyten zu einer Erwärmung. Daher treten Stromverluste auf.
Elektrolysen haben in Labor und Technik eine große Bedeutung. Beispiele dafür sind:
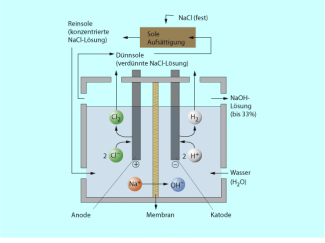
Chloralkalielektrolyse zur Herstellung von Chlor und Alkalihydroxiden.
Schmelzflusselektrolysen zur Gewinnung und Reinigung von Metallen (Natrium, Aluminium).
Synthese von Wasserstoff und Sauerstoff durch Elektrolyse von Wasser.
Galvanotechnik (Elektroplattieren) zum elektrolytischen Abscheiden von dünnen Metallschichten (Kupfer, Chrom, Nickel).
Die an den Elektroden abgeschiedenen Stoffmengen n sind der dazu erforderlichen Strommenge proportional. Das stellte M. FARADAY fest (faradaysche Gesetze).
-
Aufbau einer Elektrolyseapparatur
gstraub - shutterstrock
Elektrolyse des Wassers
Da Wasser kein Elektrolyt ist, den elektrischen Strom also nicht leitet, wird bei der Elektrolyse des Wassers ein Elektrolyt z. B. verdünnte Schwefelsäure oder Kaliumhydroxid hinzugefügt.
Die positiv geladenen Wasserstoff-Ionen wandern zur negativen Elektrode (Katode) und werden dort unter Bildung von Wasserstoff entladen (reduziert), die Hydroxid-Ionen werden an der Anode zu unbeständigen OH-Radikalen oxidiert, die zu Wasser und Sauerstoff weiter reagieren.
Die anderen in der Lösung noch enthaltenen Ionen z. B. Sulfat-Ionen oder Kalium-Ionen werden unter den gewählten Bedingungen (Spannung) nicht an den Elektroden abgeschieden.
Die Volumina der an den Elektroden gebildeten Gase Wasserstoff und Sauerstoff verhalten sich wie 2 zu 1.
Das entspricht dem Stoffmengenverhältnis H : O = 2 : 1 im Wasser.
Elektrolyse einer Natriumchloridschmelze
Die physikalisch-chemischen Abläufe während der Elektrolyse lassen sich anhand des Beispiels einer NaCl-Schmelze erläutern.
In der Schmelze liegen positiv geladene Natrium-Ionen und negativ geladene Chlorid-Ionen vor.
Die Natrium-Kationen wandern zur Elektronen liefernden Elektrode (Katode) und werden dort zu Natrium reduziert.
Die nun elektrisch neutralen Natrium-Atome verbleiben an der Katode und können über geeignete technische Vorrichtungen als metallisches Natrium gewonnen werden.
Die zur Anode wandernden Chlorid-Ionen geben Elektronen ab, sie werden zu Chloratomen oxidiert.
Die unbeständigen Chloratome bilden Chlormoleküle. Das gebildete Chlor wird an der Anode aufgefangen, gereinigt und in Druckbehältern abgefüllt.
-
Elektrolyse: Mit dem Transport von Ladung ist ein Stofftransport verbunden.