Elektrolyte
Elektrolyte sind chemische Stoffe, die im festen, flüssigen oder gelösten Zustand in Ionen dissoziieren und so einen Stromtransport durch Ionenverschiebungen ermöglichen.
Elektrolyte sind chemische Stoffe, die im festen, flüssigen oder gelösten Zustand in Ionen dissoziieren und als Leiter 2. Ordnung elektrischen Strom durch Ionenverschiebungen leiten. Es sind ionenleitende Systeme, deren elektrische Leitfähigkeit durch Dissoziation zustande kommt.
Bei der Leitung des elektrischen Stromes durch Materie werden drei Varianten unterschieden:
- Die Leitung in festen oder flüssigen Metallen, Legierungen sowie in Grafit und manchen Metalloxiden oder -carbiden, erfolgt durch frei bewegliche Elektronen.
- Die Leitung in Halbleitern erfolgt durch Elektronen und durch sog. Löcher (Defektelektronen).
- Die Leitung in Salzen in ihrem festen, flüssigen oder gelösten Zustand, erfolgt durch Ionen.
Elektrolyte können in echte und potenzielle Elektrolyte eingeteielt werden.
- Echte Elektrolyte sind Stoffe, bei denen die Ionen unabhängig vom Aggregatzustand bereits vorgebildet sind. Unter geeigneten Bedingungen, z. B. beim Schmelzen oder Lösen in einem geeigneten Lösungsmittel, bilden diese Stoffe Ionen, die bei einer angelegten Spannung den Ladungstransport übernehmen können.
- Potenzielle Elektrolyte sind Stoffe, die erst durch eine Reaktion mit dem Lösungsmittel Ionen bilden.

Ebenso unterteielt man in schwache und starke Elektrolyte.
Schwache Elektrolyte sind solche Stoffe, deren Dissoziationsgleichgewicht weit auf der Seite der undissoziierten Ausgangsprodukte liegt, die Dissoziation ist unvollständig.
Bei Lösen von Ethansäure (Essigsäure) in Wasser bilden sich nur wenige Acetat-Ionen und hydratisierte Protonen. Das Dissoziationsgleichgewicht liegt stark auf der linken Seite der Reaktionsgleichnung. Ethansäure ist also ein schwacher Elektrolyt.
Starke Elektrolyte
sind solche Stoffe, deren Dissoziation ein einem entsprechenden Lösungsmittel nahezu vollständig erfolgt.
Schwefelsäure ist ein starker Elektrolyt, weil in wässriger Lösung keine undissoziierten HSO Moleküle mehr vorliegen.
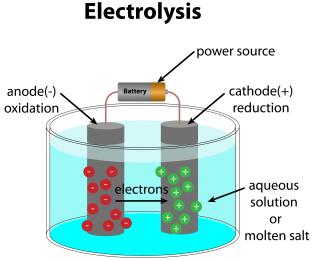
Die Leitfähigkeit der Elektrolyte nimmt mit steigender Temperatur zu, da sich die Geschwindigkeit der frei beweglichen Ionen erhöht. Bei elektrochemischen Prozessen erfolgt neben dem Ladungstransport auch ein Stofftransport. Die positiv geladenen Ionen wandern zur Katode (Kationen), die negativ geladenen Ionen wandern zur Anode (Anionen).
Elektrolyte sind in der Natur und Technik von großer Bedeutung und u.a. Voraussetzung für:
- Stofftransport von Mineralien und Pflanzen
- Aufrechterhaltung der Säure-Base-Gleichgewichte in Pflanzen und Tieren
- Transport von Pflanzennährstoffen im Boden
- Prozesse der Elektrolyse
-
Aufbau einer Elektrolyseapparatur
gstraub - shutterstrock

