Essigsäure
Die Essigsäure ist eine der wichtigsten organischen Säuren in unserem Leben. Sie ist nicht nur ein wichtiger Bestandteil in unserem Stoffwechsel, sondern auch ein Genuss- und Würzmittel, außerdem ein Rohstoff in der Industrie. Sie entsteht auf natürlichem Wege durch Essigsäuregärung. So kann man sie gezielt gewinnen, besonders zum Einsatz als Speiseessig.
Der Essig (latein.: acetum) ist ein saures Genuss-, Würz-, und Konservierungsmittel, das bereits den Menschen um 5000 vor Christus bekannt war.
HIPPOKRATES beschrieb die Anwendung des Essigs als innerliches und äußerliches Heilmittel. Über viele Jahrhunderte benutzte man die Säurelösung als Desinfektionsmittel. So wurden zum Beispiel die Pestmasken während der todbringenden Epidemien in Essig getränkt.
Die Geschichte des Essigs
Die Gewinnung von Essig in der Antike ist vermutlich eine zufällige Entdeckung bei der Vergärung von Traubensaft zu Wein. Bei der alkoholischen Gärung wandeln Hefen den Zucker in den Früchten in Ethanol und Kohlenstoffdioxid um. Dabei müssen die Gärgefäße vor Zutritt von Luft geschützt werden. Bei Anwesenheit von Sauerstoff können sich nämlich Essigsäurebakterien, die in den Wein gelangt sind, stark vermehren. Diese oxidieren dann mithilfe des Luftsauerstoffs den Ethanol enzymatisch zu Essigsäure, der Wein wird sauer.
Analog kann man aus anderen Obstsäften, in denen zunächst eine alkoholische Gärung stattfand, Obstessig wie Apfelessig herstellen.
Bei der Gärung entstehen aber auch noch geringe Mengen anderer organischer Verbindungen, z. B. Aldehyde und Ester. Diese sind abhängig von der jeweiligen Obstsorte ung tragen so zum typischen Aroma bei.
Bei dieser enzymatischen Oxidation kann man aber nur eine Höchstkonzentration von etwa 15 % Essigsäure erhalten, weil die Enzyme bei höherer Konzentration unwirksam werden. Sie vergiften sich praktisch selbst.
Speiseessig hat eine Konzentration von 5-10 % Essigsäure, es gibt auch Essig-Essenz mit 25 % Essigsäure im Handel.
Essig war damals wie heute ein wichtiges Konservierungsmittel und Gewürz. In alten Schriften wird er als Erfrischungsgetränk für Reisen, auf der Jagd, auf Eroberungszügen und bei der Arbeit erwähnt.
Aufbau und Eigenschaften der Ethansäure
Die Essigsäure ist umgangssprachlich nach dem Würzmittel benannt. Ihr systematischer Name ist Ethansäure.
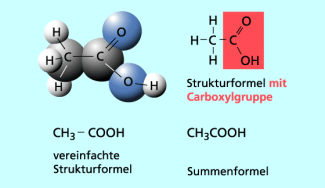
Es handelt sich um eine organische Säure (Carbonsäure), deren Moleküle zwei Kohlenstoffatome besitzen, die mit einer Einfachbindung miteinander verbunden sind (gesättigte Alkansäure).
Die funktionelle Gruppe ist, wie bei allen anderen Carbonsäuren auch, die Carboxylgruppe -COOH.
Die stark vereinfachte Strukturformel der Essigsäure ist .
physikalische Eigenschaften:
molare Masse: 60,1 g/mol
Dichte: 1,044 (bei 25 °C)
Schmelztemperatur: 16,7 °C
Siedetemperatur: 117,9 °C
chemische Eigenschaften:
Ethansäure ist eine stechend riechende, farblose, klare, stark hygroskopische (Wasser anziehende) Flüssigkeit.
Wasser freie Essigsäure wird Eisessig genannt. Der Name rührt daher, dass die reine Ethansäure schon bei 16,7 °C zu eisähnlichen Kristallen erstarrt.
Ethansäure ist mit Wasser, Ether, Chloroform, Ethanol, und anderen Alkoholen in jedem beliebigen Verhältnis mischbar.
Die Ethansäure ist eine schwache Säure. Das bedeutet, dass sie mit Wasser nicht vollständig zu den Acetat-Ionen und Wasserstoff-Ionen (bzw. Hydronium-Ionen) reagiert.
Durch die entstandenen, frei beweglichen Ionen ist die Ethansäurelösung elektrisch leitfähig.
Reaktionsgleichung nach Arrhenius:
![]()
Reaktionsgleichung nach Brönsted:
CH3COOH + H2O → CH3COO- + H3O+
Ethansäure + Wasser → Acetat-Ion + Hydronium-Ion
-
Modell und Formeln des Ethansäuremoleküls
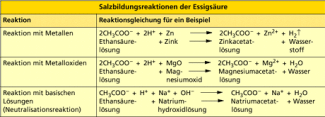
Salzbildungsreaktionen der Essigsäure
Typisch für Säuren sind Salzbildungsreaktionen. Auch die Essigsäure bildet Salze. Ihre Salze heißen Acetate.
Bei dieser Reaktion können auch giftige Reaktionsprodukte entstehen. Beispielsweise bildet sich mit Blei das giftige, süßlich schmeckende Bleiacetat (Bleizucker). In der Antike wurden bei den Römern aber bleihaltige Gefäße als Küchengeräte genutzt und Keramiken hatten bleihaltige Glasuren. Durch saure Speisen oder Getränke wurden geringe Bleimengen aufgelöst. Anhand von Skelettfunden konnte man nachweisen, dass chronische Bleivergiftungen zur damaligen Zeit offenbar sehr häufig waren.
Die Salze von anorganischen Säuren, z. B. die Carbonate der Kohlensäure werden durch Säuren zersetzt. Auch hier reagiert Ethansäure wie anorganische Säuren. Sie reagiert mit Carbonaten und anderen Salzen.
![]()
Eine typische Reaktion der Ethansäure ist die Esterbildung. Ethansäure kann aufgrund ihrer Carboxylgruppe mit Alkoholen reagieren.
Dabei entstehen Ethansäureester, z. B. Ethansäureethylester.
![]()
Ethansäure erkennt man noch in sehr geringen Konzentrationen an ihrem typischen Essiggeruch. Acetate lassen sich mit Eisen(III)-chlorid-Lösung nachweisen. Es bildet sich ein tiefroter Komplex, der sich beim Zusatz von Salzsäure wieder entfärbt. Diese Reaktion dient auch als spezieller Nachweis für diese Carbonsäure.
Herstellung der Ethansäure
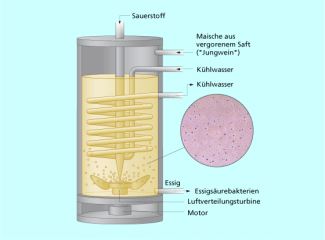
Die älteste bekannte Methode zur Herstellung von Essigsäure ist die Essigsäuregärung durch Essigsäurebakterien, bei der unter Sauerstoffzufuhr mithilfe der Enzyme der Essigsäurebakterien ethanolhaltige Flüssigkeiten oxidiert werden.
Auch wenn dieser Stoffwechselprozess als Gärung bezeichnet wird, gehört er eigentlich nicht in diese Gruppe, denn die Essigsäuregärung findet, im Gegensatz zu den eigentlichen Gärungsvorgängen, nur mit Sauerstoff statt. Dabei wird Ethanol („Alkohol“) oxidiert.
Ethanol + Sauerstoff --> Essigsäure + Wasser
Die biotechnologische Herstellung erfolgt in großen Holzbottichen. Über Buchenholzspäne wird ein Gemisch verrieselt, das Ethanol („Alkohol“) enthält.
Die Belüftung wird von unten durchgeführt, sodass für die Essigsäuregärung ausreichend Sauerstoff vorhanden ist (siehe Bild 3).
Technisch kann Ethansäure auch durch andere Verfahren gewonnen werden.
1. Bei der katalytischen Oxidation von z. B. Butan mit Luftsauerstoff entsteht Essigsäure im Gemisch mit zahlreichen anderen verwertbaren organischen Verbindungen (u.a. Ameisensäure).
2. Die Herstellung aus Ethin (Acetylen) über Ethanal (Acetaldehyd) zu Ethansäure wurde ab dem Jahre 1914 technisch angewendet.
Dabei entsteht ein Rohessig (technischer Essig) mit einer Konzentration von bis zu 95 %.
3. Es ist ebenfalls möglich, die Ethansäure aus Methanol und Kohlenstoffmonooxid zu gewinnen.
Die so hergestellte Ethansäure wird hauptsächlich zur Herstellung von verschiedenen Ethansäureestern verwendet, die wegen ihres fruchtartigen Geruches in der Parfümerie benötigt werden.
Die Salze der Ethansäure, wie z. B. Natrium-, Aluminium-, Zink- und Bleiacetat, finden in der Leder- und Textilindustrie Anwendung, sowie in der Medizin und Färberei.
Die Ethansäure dient ebenfalls als Lösungsmittel und Zwischenprodukt bei organischen Synthesen. Im Handel sind folgende Arten:
1. technische Essigsäure: 30 bis 50 %,
2. technischer Eisessig: 93 bis 96 %, hochkonzentriert,
3. Eisessig: 96 bis 99 %, erstarrt bei Kälte zu einem eisartigen, festen Stoff.
-
Biotechnologische Herstellung von Ethansäure