festes Wasser, Eis
Von festem Wasser (Eis) sind mehr Zustände bekannt, als von jeder anderen festen Substanz. Den meisten Modifikationen gemeinsam ist aber, dass sie voluminöser und damit leichter als flüssiges Wasser sind. Die Ursache ist aus der Struktur von „normalem Eis“ zu erkennen. In dieser Struktur bilden Wassermoleküle ein Gitter mit Hohlräumen, die so groß sind, dass sich sogar andere Moleküle darin einlagern können.
Die besondere Struktur von Eis ist von großer Bedeutung in der Natur, z. B. für das Überleben von Wasserorganismen im Winter oder für die in der Arktis lebenden Eskimos.
Die Struktur von Eis ist durch 12 unterschiedliche Kristallgitter und 2 amorphe Modifikationen gekennzeichnet. Damit sind von festem Wasser (Eis) mehr Zustände bekannt, als von jeder anderen festen Substanz. Die verschiedenen Strukturen konnten durch Röntgenstrukturanalyse, einer Analysenmethode zur Aufklärung von Kristallstrukturen, bestimmt werden.
Eis entsteht durch Gefrieren von Wasser. Dabei können sich Hagel, Reif, Blockeis oder Schnee, mit oft charakteristischen Kristallformen (Schneeflocken) bilden. Wer schon einmal Ski gelaufen ist weiß, dass es viele verschiedene Formen von Schnee gibt. Die Eskimos kennen deshalb viele verschiedene Worte für Wasser in gefrorenem Zustand. Die Erkennung der unterschiedlichen Schneestrukturen sichert ihnen das Überleben in dieser rauen Umgebung. In der Schweiz gibt es Wissenschaftler, die sich mit der Strukturveränderung beim Schnee befassen, um dann Aussagen über mögliche Lawinengefahren machen zu können.
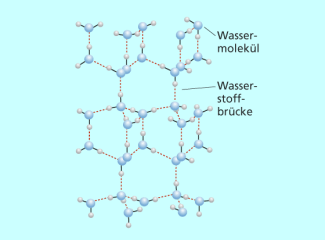
Die häufigste kristalline Modifikation von Eis wird auch als „ normales Eis “ bezeichnet (Abkürzung E. I.). Sie ist auf den Gittertyp des Tridymits zurückzuführen. Die Wassermoleküle sind hexagonal und die Sauerstoffatome tetraedrisch angeordnet. Zwei Wasserstoffatome sind kovalent an ein Sauerstoffatom gebunden und zwei über Wasserstoffbrückenbindungen. In diesem Molekülgitter existieren Hohlräume, die dazu führen, dass das Volumen des Eises größer ist als das des flüssigen Wassers.
Deshalb ist der Übergang vom festen in den flüssigen Zustand mit einer Volumenabnahme verbunden. Außerdem findet der Übergang von einem energiereichen (d. h. flüssigen) in einen energieärmeren (d. h. festen) Zustand statt. Die demzufolge frei werdende Energie wird in Form von Erstarrungswärme abgegeben und muss beim Schmelzen wieder zugeführt werden.
Eis ist in reiner Form farblos, erscheint jedoch oft bläulich bis leicht grünlich. Dies ist darauf zurückzuführen, dass Eis sehr leicht Einschlussverbindungen (sogenannte Clathrate) bildet. Dabei lagern sich Moleküle anderer gasförmiger Stoffe (z. B. Kohlenstoffdioxid, Stickstoff u. a.) in die Hohlräume des Molekülgitters ein.
Diese Tatsache nutzt man zur Bestimmung der Zusammensetzung der Atmosphäre in früheren Erdzeiten. Man hat Bohrungen in die mehrere Kilometer dicken Eisschilde von Grönland und der Antarktis niedergebracht. In den gezogenenen Bohrkernen kann man „Jahresschichten“ ähnlich der Jahresringe an Bäumen erkennen. Wenn man diese Jahresscheiben herausschneidet und auftaut, kann man die eingeschlossenen Gase analysieren. Auf diese Weise konnte man Rückschlüsse u. a. über den Kohlenstoffdioxidgehalt der Luft vor mehreren Hunderttausend Jahren ziehen.
Sehr große Mengen von Methan-haltigem Gashydrat (meist einfach als Gashydrat bezeichnet) sind am Meeresboden in den Kontinentalabhängen sowie im Dauerfrostboden der Tundra vorhanden. Das darin eingeschlossene Methan könnte einerseits eine große Rohstoffquelle darstellen. Auf der anderen Seite scheint aber die Gefahr größer, dass bei einem Fortschreiten der Erderwärmung Methan aus dem Dauerfrostboden freigesetzt werden könnte. Da Methan selbst ein Treibhausgas ist, würde das die Erderwärmung zusätzlich beschleunigen.
-
Struktur von „normalem“ Eis