Flammenfärbung
Bei der qualitativen chemischen Analyse wird als Vorprobe die Flammenfärbung genutzt. Durch ein Spektroskop betrachtet, werden diskrete, charakteristische Linien sichtbar, die sowohl eine qualitative als auch eine quantitative Charakterisierung ermöglichen
Die Flammenfärbung
Die Lichteffekte beim Feuerwerk sind u. a. auf die Flammenfärbung zurückzuführen, die einige Alkali- und Erdalkalimetalle hervorrufen.
Die Gasflamme im Haushalt brennt fahlblau. Wird in der Nähe ein Salzstreuer genutzt, so leuchtet die Flamme gelb. Die in der Luft der Flamme zugeführten Kochsalzpartikel (NaCl) haben zu dieser Erscheinung geführt. Mehrere Elemente (Rubidium, Cäsium) wurden aufgrund ihrer charakteristischen Flammenfärbung von BUNSEN und KIRCHHOFF entdeckt.
Die Flammenfärbung als Vorprobe bei der qualitativen Analyse
Bei diesem Verfahren wird die zu untersuchende Probe fein gemörsert und mit einigen Tropfen Salzsäure versetzt. Die Chloride der Elemente sind besonders leicht verdampfbar und in die Gasphase zu überführen. Wird in die Suspension nun ein vorher ausgeglühtes Magnesiastäbchen (Magnesiumoxid) getaucht und die anhaftende Probe in die entleuchtete, rauschende Brennerflamme gebracht, so verdampfen bei den in der Flamme herrschenden Temperaturen von bis zu 1100°C (Bild 1). Anteile der Probe und führen bei Anwesenheit von Verbindungen die Lithium, Natrium, Kalium, Rubidium, Cäsium, Calcium, Strontium oder Barium enthalten z. T. charakteristischen Flammenfärbungen. Am intensivsten ist die Flammenfärbung bei der Anwesenheit von Natrium. Da Spuren von Natriumverbindungen überall vorhanden sind, ist bei allen Proben eine kurzzeitige Gelbfärbung der Flamme zu beobachten.
-
Durchführung einer Flammenprobe
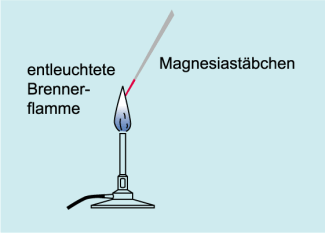
Wie ist die Flammenfärbung zu erklären?
Wenn z. B. Natriumchlorid erhitzt wird, so sublimiert ein geringer Teil und wird somit in die Gasphase übergeführt. Die Flammenenergie reicht aus, um aus den NaCl-Molekülen Natrium- und Chloratome zu bilden. Die Natriumatome sind in der Lage weitere Energie aufzunehmen. Es entstehen angeregte Na-Atome. Bei diesen angeregten Na-Atomen ist das Valenzelektron (3s) unter Energieaufnahme in ein höheres Energieniveau überge-gangen. Dieser Zustand hat nur eine mittlere Lebensdauer von etwa 10-9 s. Beim Übergang in den Grundzustand wird die zur Anregung erforderliche Energie abgeben, die der gelben Farbe entspricht (λ = 589 nm).
Die starke gelbe Flammenfärbung von Natrium in Probengemischen oder durch Verunreinigung mit Spuren von Natriumsalzen aus der Luft erschwert das Erkennen anderer Flammenfarben. Man kann die Brennerflamme durch ein blaues Kobaltglas betrachten. Dabei werden die Gelbanteile des Lichts herausgefiltert. Durch Kobaldglas betrachtet erscheinen allerdings auch die charakteristischen Farben der anderen Elemente ein wenig anders.
| mit Cobaltglas | ohne Cobaltglas | |
|---|---|---|
| Lithium | violett | rot |
| Kalium | karminrot | violett |
| Calcium | hellgrün | ziegelrot |
| Strontium | violett | karminrot |
| Barium | blaugrün | grün |
Handspektroskop
Werden die Flammenfärbungen durch ein Handspektroskop betrachtet, so können charakteristische Linien beobachtet werden. Das im Spektroskop enthaltene Prisma beugt die ausgesandten Wellen je nach ihrer Wellenlänge unterschiedlich, sodass einzelne Spektrallinien zu beobachten sind, deren Lage für das entsprechende Element charakteristisch ist (Atomspektroskopie).
Bei der Betrachtung mit dem Spektroskop ist es auch möglich beim Vorliegen von Gemischen die darin enthaltenen Elemente anhand der beobachteten Linien zu identifizieren.
Charakteristische Emissionslinien der Alkali- und Erdalkalimetalle (nm):
| Li | 671 | Cs | 458 |
| Na | 589 | Ca | 622, 553 |
| K | 768, 404 | Sr | 675, 606 |
| Rb | 780, 421 | Ba | 524, 514 |
Das Flammenfotometer
Eine Methode der Atomspektroskopie zur quantitativen Analyse ist die Flammenfotometrie. In klinischen Laboratorien wird z. B. der Gehalt an Natrium, Kalium und Calcium im Blut mit dieser Methode ermittelt. Dabei wird die Probe in die Flamme gebracht und man misst die Intensität der Emission bei einer für das jeweilige Element charakteristischen Linie. Da die Intensität der Emissionen von der Zahl der zur Emission fähigen Atome proportional ist, lässt die Flammenfotometrie quantitative Aussagen über die Zusammensetzung der Probe zu. Zuvor wird mithilfe bekannter Proben kalibriert.
Weitere Flammenfärbungen
Auch andere als die oben genannten Elemente führen zu Flammenfärbungen. Bekannt sind z. B. die Leuchterscheinungen bei Kupferverbindungen (Beilsteinprobe; blaugrün) oder Borverbindungen (grüne Flamme beim Verbrennen des Borsäuretrimethylesters, B(OCH). Hier handelt es sich aber nicht um Atomspektren, die im Handspektroskop diskrete Linien ergeben, sondern um Molekülspektren, die im Spektroskop als farbige Bänder sichtbar werden. Auch diese Verbindungen werden in der Feuerwerkerei genutzt.
-
Flammenfärbungen einiger Metalle


