Halogene
Die Halogene stellen die 7. Hauptgruppe des Periodensystems dar. Zu ihnen gehören die Elemente Fluor, Chlor, Brom, Iod und das radioaktive Astat. Sie sind Nichtmetalle und bilden im elementaren Zustand zweiatomige Moleküle, deren Flüchtigkeit mit zunehmender Ordnungszahl abnimmt.
Weil den Halogenatomen nur ein einziges Elektron fehlt, um Edelgaskonfiguration zu erreichen, reagieren sie leicht, indem sie Elektronen aufnehmen. Aufgrund ihrer großen Reaktivität kommen sie in der Natur nur in Form ihrer Verbindungen vor.
Atombau und Gruppeneigenschaften
Die Halogene stehen in der siebten Hauptgruppe des Periodensystems. Zu ihnen gehören die Elemente Fluor (F), Chlor (Cl), Brom (Br), Iod (I) und das radioaktive Astat (At).
Aus der Stellung der Halogene im Periodensystem lässt sich ablesen, dass sie sieben Elektronen auf der äußeren Schale haben und somit durch Aufnahme eines einzigen Elektrons Edelgaskonfiguration erreichen. Aus diesem Grund gehören die Halogene zu den reaktionsfähigsten Elementen und reagieren leicht, indem sie Elektronen unter Bildung von Halogenid-Ionen (X -) aufnehmen. Fluor ist das Element mit der höchsten Elektronegativität und Reaktivität überhaupt. Innerhalb der Gruppe nimmt beides nach unten ab.
Die Edelgaskonfiguration wird von den Halogenen ebenfalls erreicht, wenn sie eine Atombindung ausbilden, weshalb sie im elementaren Zustand als zweiatomige Moleküle () vorliegen.
Alle Halogene sind Nichtmetalle , wobei der Nichtmetallcharakter von Fluor zu Astat abnimmt. Iod weist metallischen Glanz auf und leitet im flüssigen Zustand den elektrischen Strom.
Die Schmelz- und Siedepunkte nehmen mit steigender Ordnungszahl zu, weil mit steigender Atommasse die van-der-Waals-Kräfte, die zwischen den Molekülen wirken, stärker werden. Trotzdem sind die Halogene flüchtige Verbindungen: Fluor und Chlor sind bei Standardbedingungen gasförmig, Brom ist zwar flüssig, verdampft aber leicht bei Raumtemperatur, was sich an den aufsteigenden rotbraunen Dämpfen gut erkennen lässt. Iod und Astat sind fest, Iod sublimiert aber bereits bei Raumtemperatur. Astat ist radioaktiv und zerfällt sehr schnell, sodass es bisher nicht möglich war, es genauer zu untersuchen.
Die Farbigkeit der Halogene nimmt von Fluor zu Iod hin zu – Fluor ist ein schwach gelbgrünes Gas, Chlor ein grünes Gas, Brom eine rotbraune Flüssigkeit und Iod im festen Zustand dunkelgrau.
Die Halogene reagieren heftig mit anderen Stoffen, insbesondere mit unedlen Metallen, die leicht Elektronen abgeben. Weil sie auch mit Wasser und organischen Verbindungen reagieren, sind sie beim Einatmen giftig und wirken ätzend. In der Natur kommen sie nicht elementar vor.
Eigenschaften und Verwendung der Elemente
Als reines Element ist Fluor bei Zimmertemperatur ein sehr schwach gelbgrünes Gas, das stark ätzend und hoch giftig ist. Fluor reagiert spontan mit den meisten Elementen und Verbindungen. Fluor ist das elektronegativste Element.
Verbindungen, die Wasserstoff enthalten, werden sofort von Fluor angegriffen, wobei Wasserstoff gegen Fluor ausgetauscht (substituiert) wird und Fluorwasserstoff entsteht.
Sein Name kommt vom lateinischen Wort fluor (= Fluss, Fließen), weil Fluoride Metallerzen zugesetzt werden, um deren Schmelzen flüssiger zu machen.
-
Die 7. Hauptgruppe und Gruppeneigenschaften der Halogene

Elementares Fluor wird hauptsächlich zur Herstellung von fluorhaltigen Verbindungen verwendet, die sich auf anderem Wege nicht herstellen lassen, z. B. von fluorhaltigen organischen Stoffen wie Polytetrafluorethen (Teflon®), der als Antihaftbeschichtung für Bratpfannen oder zur Herstellung atmungsaktiver Membranen wie Gore-Tex® eingesetzt wird. Fluor wird in größeren Mengen für die Herstellung von Kernbrennstoff benötigt. In der Natur vorkommendes Uran hat drei Isotope, Uran-238 (99,28 %), Uran-235 (0,72 %) und Uran-234 (0,006 %). Für die Kernspaltung ist aber nur Uran-235 geeignet und der natürliche Gehalt reicht für die Aufrechterhaltung der Kernsspaltung nicht aus. In den Brennelementen der Kernkraftwerke ist daher der Anteil an Uran-235 auf etwa 3 % angereichert.
Die Anreicherung erfolgt so, dass Uran mit Fluor zum gasförmigen Uranhexafluorid umgesetzt wird. Mithilfe von großen Zentrifugen können dann die geringen Massenunterschiede, die von den nun gasförmig vorliegenden Uranisotopen herrühren, für eine Anreicherung von U-235 genutzt werden.
Chlor ist bei Raumtemperatur ebenfalls ein giftiges Gas von grünlicher Färbung. Beim Einatmen greift es die Schleimhäute an und wirkt ätzend, was ein Grund für seine Giftigkeit ist.
Chlor reagiert mit vielen Metallen, vor allem bei erhöhter Temperatur, schnell zu den Chloriden. Auch mit den meisten Nichtmetallen reagiert es bereits bei niedrigen Temperaturen.
Der Name Chlor stammt von der griechischen Bezeichnung chloros (= gelbgrün) wegen seiner grünlichen Farbe.
Chlor ist ein wichtiger Ausgangsstoff für die chemische Industrie und wird hauptsächlich zur Synthese organischer Produkte eingesetzt. Darunter sind auch viele chlorfreie Endprodukte, die über chlorhaltige Zwischenstufen hergestellt werden.
Aus Chlor werden außerdem wichtige anorganische Verbindungen wie Salzsäure , Chloride, Hypochlorite, Chlorate und Chlorkalk (Bleichkalk) hergestellt. Weitere Verwendung findet Chlor als Oxidationsmittel, Bleichmittel, zur Desinfektion von Trinkwasser und Badewasser in Bädern sowie beim Entzinnen von Weißblech.
Die Wirkung vieler chemischer Kampfstoffe wie Senfgas, Phosgen oder Tränengase, in denen das Chlor chemisch gebunden ist, beruht u. a. darauf, dass in Verbindung mit Wasser der ätzende Chlorwasserstoff freigesetzt wird. Aber auch in der Medizin ist Chlor in vielen Medikamenten enthalten. So wurde früher Chloroform als Narkosemittel eingesetzt, heute findet man Chlor in Chloramphenicol, einem Antibiotikum, oder in Schlaf- und Beruhigungsmitteln wie Chloralhydrat und Chlorprothixen.
-
Zylinder mit Chlorgas

Brom als drittes Element der 7. Hauptgruppe ist bei Raumtemperatur eine tiefbraune Flüssigkeit, die leicht verdampft. Diese Bromdämpfe sind sehr gefährlich, weil sie wie flüssiges Brom selbst starke Verätzungen hervorrufen. Ebenso wie Chlor reagiert Brom mit vielen Elementen schon bei niedrigen Temperaturen, ist aber insgesamt weniger reaktiv als Chlor.
Benannt wurde es wegen seines unangenehmen Geruchs nach dem griechischen Wort bromodes (= stinkend).
Ein Großteil des Broms wird zur Herstellung von Bleich- und Desinfektionsmitteln benutzt. Auch findet man Brom in Feuerschutzmitteln, in Tränengasen, aber auch in einigen Narkosegasen. In der Landwirtschaft werden viele Wurm-, Insekten-, Pilz- und Unkrautvernichtungsmittel verwendet, die Brom enthalten. Wichtig ist das Silberbromid in der Fotografie.
Iod ist bei Normaltemperatur ein grauschwarzer Feststoff. Es sublimiert sehr leicht. Legt man einige Iodkristalle in ein geschlossenes Gefäß, so färbt sich die Gasphase darin rasch violett. Dieser Färbung verdankt es seinen Namen, der abgeleitet ist vom griechischen Wort ioeides (= veilchenfarben).
Iod ähnelt in seinen Reaktionen denen des Chlors und des Broms, ist jedoch weniger reaktiv als diese.
Iod lässt sich durch die sogenannte Iod-Stärke-Reaktion nachweisen. Gibt man Iod zu einer wässrigen Stärkelösung, so färbt sich die Lösung blau, weil die Iod-Moleküle in die spiralförmigen Stärke-Moleküle eingelagert werden und die entstehende Einschlussverbindung blau ist.
Elementares Iod dient z. B. zur Herstellung von Arzneimitteln und Desinfektionsmitteln. Zur Desinfektion wird z. B. Iodtinktur , eine Lösung von Iod und Kaliumiodid in Ethanol, verwendet. Das radioaktive Isotop wird für Schilddrüsenuntersuchungen eingesetzt.
Eine Anwendung findet Iod in vielen verschiedenen Halogenlampen. Bei normalen Glühlampen mit Wolframdraht kommt es durch die starke Erhitzung des Drahtes zum Austritt von einzelnen Wolframatomen, sodass der Draht nach und nach seine Stabilität verliert und durchbrennen kann. Bei Halogenstrahlern sind geringe Mengen Iod in der Lampe enthalten, die die austretenden Wolframatome binden. Diese Wolfram/Iod-Verbindung schlägt sich am Glühfaden nieder, wo sie wieder in Wolfram und Iod gespalten wird. Dies hat zwei Vorteile. Zum einen bleibt der Glühfaden länger intakt, sodass Halogenlampen eine längere Lebensdauer besitzen, zum anderen kann so eine größere Strommenge durch den Draht geleitet werden, ohne dass dieser durchbrennt, somit brennt die Lampe viel heller.
Über Astat ist nicht viel bekannt, da es radioaktiv ist und sehr schnell zerfällt. Am ehesten ist es mit Iod vergleichbar, so ist es ebenfalls ein Feststoff. Seinen Namen hat es vom griechischen Wort astatos (= unbeständig).
Vorkommen:
Da die Halogene äußerst reaktiv sind, kommen sie in der Natur nur gebunden vor. Auch ihr Name, der vom griechischen hals (= Salz) und gennan (= erzeugen) abgeleitet ist, weist darauf hin, dass die Halogene (= Salzbildner) in Form ihrer Salze zu finden sind.
Fluor ist in der Natur unter anderem in Flussspat (Bild 7) und Kryolith enthalten. Im Körper ist es als Fluorapatit in Knochen und im Zahnschmelz enthalten.
Chlor findet man in großen Mengen im Stein- bzw. Kochsalz NaCl sowohl im Meerwasser gelöst als auch fest unter Tage, außerdem im KCl (Sylvin) und vielen anderen Salzen. Die größten Mengen finden sich im Meerwasser, das zu 2 % aus Chlorid-Ionen besteht.
Brom trifft man oft mit den Chloriden zusammen an, so ebenfalls im Meerwasser oder als KBr gemeinsam mit KCl.
-
Natriumchloridkristalle

Iod findet man als Calciumiodat (Lautarit) zusammen mit Chilesalpeter . Außerdem reichern sich Iodide in der Tier- und Pflanzenwelt des Meeres, vor allem in Algen an. Im menschlichen Körper findet man vergleichsweise große Mengen an Iodiden in der Schilddrüse, die zur ordentlichen Funktion eine tägliche Menge von ca. 200 mg Iodid benötigt.
Astat entsteht in der Natur nur durch den Zerfall anderer radioaktiver Elemente und zerfällt recht schnell weiter, sodass es stets nur in Spuren zu finden ist. Das stabilste bekannte Astat-Isotop hat eine Halbwertszeit von nur 8,3 Stunden, d. h. nach 8,3 Stunden ist die Hälfte der Astatatome zerfallen. Da Astat so instabil ist, dass es schlecht untersucht werden kann, werden im Folgenden nur die übrigen Halogene behandelt.
Gewinnung
Fluor gewinnt man durch die Elektrolyse von Fluorwasserstoff HF. Zur Erhöhung der Leitfähigkeit gibt man zu dem flüssigen Fluorwasserstoff Kaliumfluorid. Bei der Elektrolyse muss wasserfrei gearbeitet werden, weil sonst an der Anode nicht Fluorid zu Fluor, sondern Wasser zu Sauerstoff oxidiert wird.
2 HF • KF –→ H2 (Katode) + F2 (Anode)
Chlor gewinnt man hauptsächlich durch die Chloralkali-Elektrolyse , bei der eine Natriumchlorid-Lösung als Ausgangsstoff dient. Bei der Elektrolyse werden an der Anode Chloridionen zu Chlor oxidiert. An der Katode wird (beim Membran- und Diaphragmaverfahren) Wasser zu Wasserstoff reduziert. Die dabei entstehenden Hydroxylionen bilden dann mit den aus dem Anodenraum eingewanderten Natriumionen die Natronlauge. Diese wird kontinuierlich aus dem Katodenraum entnommen.
2 NaCl + 2 H2O –→ 2 NaOH + H2 (Katode) + Cl2 (Anode)
Für die Durchführung dieser Elektrolyse gibt es verschiedene Verfahren die sich alle ähneln und meist nur im Aufbau der Elektrolysezelle unterscheiden.
Im Labor kann man in geringem Maßstab Chlorgas durch die Umsetzung von HCl mit Braunstein (Mangandioxid) gewinnen.
Brom lässt sich auf viel einfacherem Wege gewinnen als Fluor und Chlor. Da innerhalb der 7. Hauptgruppe die Reaktivität der Elemente mit steigender Ordnungszahl abnimmt, ist Brom also weniger reaktiv als Fluor und Chlor. Es handelt sich demnach bei Chlor um ein stärkeres Oxidationsmittel als Brom. Daher kann man durch eine Redoxreaktion mittels Chlor das Bromid zu Brom oxidieren, wobei Chlor selbst zu Chlorid reduziert wird. Die hierfür nötigen Bromide gewinnt man aus Salzlagerstätten oder Meerwasser.
Beispiele:
Iod gewinnt man aus Iodat () das im Chilesalpeter () enthalten ist.
Das Iodat wird mit Schwefeldioxid zu Iod reduziert und anschließend durch Sublimation gereinigt.
Wichtige Verbindungen der Halogene
Halogenwasserstoffe
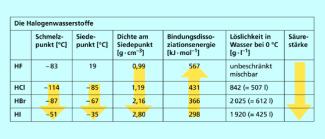
Alle Halogenwasserstoffe sind Dipolmoleküle. Die Polarität der Bindung nimmt von HI zu HF zu, weil der Elektronegativitätsunterschied größer wird. Dennoch sind die Wechselwirkungen zwischen den Molekülen relativ schwach: Außer Fluorwasserstoff, dessen Siedepunkt 20 °C beträgt, sind die Halogenwasserstoffe unter Standardbedingungen gasförmig.
Der hohe Siedepunkt von HF ist darauf zurückzuführen, dass er Wasserstoffbrückenbindungen ausbilden kann. Die anderen Halogenwasserstoffe sind dazu nicht in der Lage, weil die Elemente Chlor, Brom und Iod weniger elektronegativ sind und größere Atomradien besitzen und die Polarität ihrer Wasserstoffverbindungen daher abnimmt.
Die Halogenwasserstoffe sind gut in Wasser löslich und bilden die Halogenwasserstoffsäuren (Flusssäure, Salzsäure, Bromwasserstoffsäure, Iodwasserstoffsäure). Die Säurestärke der Halogenwasserstoffe nimmt mit wachsender Bindungslänge zu. Die stärkste Säure ist die Iodwasserstoffsäure, weil die Bindung zwischen dem großen Iodatom und dem kleinen Wasserstoffatom schwächer ist als bei den kleineren Halogenatomen.
Die Herstellung der Halogenwasserstoffe kann aus den Elementen und Wasserstoff oder aus den Halogeniden durch Umsetzung mit Säuren erfolgen.
Lässt man die Elemente direkt mit Wasserstoff reagieren, so zeigt sich deutlich, dass Fluor am leichtesten reagiert, Iod hingegen das reaktionsträgste Halogen ist. Entsprechend der Reaktivität der Halogene nimmt auch die Heftigkeit der Reaktion stark ab. Fluor reagiert bereits bei - 200 °C mit Wasserstoff unter Explosion in einer stark exothermen Reaktion. Gemische aus Chlor und Wasserstoff (Chlorknallgas) explodieren bei Belichtung, weil durch das Licht die Chlormoleküle in Chloratome gespalten werden, die mit Wasserstoff zu Chlorwasserstoff reagieren. Die Reaktionen von Brom und Iod mit Wasserstoff sind Gleichgewichtsreaktionen, d. h. die Elemente reagieren nicht vollständig zum Produkt, und der entstehende Halogenwasserstoff reagiert zurück zu den Elementen.
Für die Gewinnung von Fluorwasserstoff und Chlorwasserstoff aus Fluoriden bzw. Chloriden verwendet man konzentrierte Schwefelsäure. Will man Bromwasserstoff herstellen, muss man Phosphorsäure einsetzen, da Schwefelsäure Bromid oxidiert und daher zu Schwefeldioxid oder Schwefelwasserstoff reduziert wird. Iodwasserstoff lässt sich am besten aus den Elementen synthetisieren.
Beispiele:
-
Übersicht über die Halogenwasserstoffe
Salze der Halogene
Es gibt zahlreiche Salze, die Halogenid-Ionen enthalten. Viele davon werden in der Industrie, aber auch im täglichen Leben verwendet.
Von großer Bedeutung im Alltag ist beispielsweise das Kochsalz, mit dem wir unser Essen würzen. Sein chemischer Name ist Natriumchlorid NaCl.
In der Fotografie werden Silberhalogenide wie Silberbromid AgBr und Silberiodid AgI eingesetzt.
Zahnschmelz enthält das Mineral Hydroxylapatit Wird das Hydroxid-Ion durch Fluorid ersetzt, was durch Verwendung fluoridhaltiger Zahnpasta oder durch Fluoride im Trinkwasser bewirkt wird, so entsteht der gegen Milchsäure wesentlich beständigere Fluorapatit.
In der Industrie dienen Salze wie Calciumfluorid oder Kryolith als Flussmittel, um den Schmelzpunkt verschiedener Erze bei der Schmelzflusselektrolyse herabzusetzen. Kryolith wird bei der Aluminiumherstellung verwendet.

