Kalkbrennen
Branntkalk (Calciumoxid) ist ein wichtiger Rohstoff für die Bauindustrie, die chemische Industrie und die Metallurgie. Die Herstellung erfolgt durch das Kalkbrennen, d. h. die thermische Zersetzung von Calciumcarbonat (Kalkstein) in Calciumoxid und Kohlenstoffdioxid.
Aus Branntkalk wird Löschkalk (Calciumhydroxid) und daraus wiederum Kalkmörtel für die Bauindustrie hergestellt. Calciumhydroxid dient auch als preiswerte Base für viele Neutralisationsreaktionen in der chemischen Industrie.
Branntkalk - chemisch Calciumoxid (CaO) ist ein wichtiger Rohstoff für die Bauindustrie, die chemische Industrie und die Metallurgie. Die Herstellung erfolgt durch das sogenannte Kalkbrennen, also die thermische Zersetzung von Calciumcarbonat in Calciumoxid und Kohlenstoffdioxid.
Als Ausgangsstoff dient Kalkstein (Calciumcarbonat), der in der Natur in verschiedenen Formen und großen Mengen als Rohstoff verfügbar ist. Aus dem Carbonat wird bei Temperaturen von ca. 1000 °C Kohlenstoffdioxid abgespalten. Als Reaktionsprodukt entsteht das benötigte Calciumoxid.
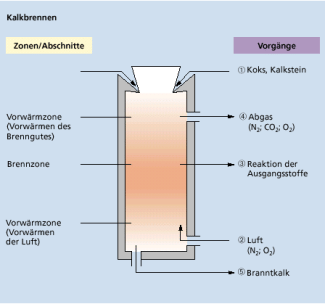
Das Brennen erfolgt häufig in Schachtöfen , die von oben periodisch - also in bestimmten, regelmäßigen Zeitabständen - mit einem Gemisch von Kalkstein und Koks befüllt werden. Von unten wird Luft zugeführt. Der entzündete Koks verbrennt und erzeugt die zur thermischen Zersetzung des Calciumcarbonats erforderliche Temperatur von 900 - 1 200 °C. Der Branntkalk wird unten aus dem Ofen periodisch entnommen.
![]()
-
Im Kalkschachtofen wird Calciumcarbonat gebrannt.
Das Brennen kann auch in Drehrohröfen durchgeführt werden. Das sind schwach geneigte Öfen von einigen Metern Durchmesser und bis zu 100 Metern Länge. Durch die leichte Neigung des Ofens und die langsame Drehung bewegt sich das eingesetzte Material langsam nach unten.
Als Brennstoff kann auch Heizöl oder Erdgas eingesetzt werden.
Reines Calciumoxid ist weiß. Branntkalk ist aber meist infolge von Verunreinigungen durch Eisenoxide grau oder bräunlich verfärbt.
Haupteinsatzgebiet von Branntkalk ist die Herstellung von Kalkmörtel für die Baustoffindustrie. Dazu wird Branntkalk „gelöscht“. Dabei reagiert der Branntkalk mit Wasser unter starker Wärmeentwicklung zu Löschkalk :
Löschkalk ist basisch und daher stark ätzend, sodass beim Arbeiten Vorsicht geboten ist.
Wird Löschkalk mit Sand oder Kies als Füllstoff vermischt, erhält man Mörtel. Das Calciumhydroxid reagiert dann langsam mit dem Kohlenstoffdioxid der Luft unter Bildung von Calciumcarbonat. Dadurch verfestigt sich der Mörtel. Der Prozess wird Abbinden genannt.
| Löschkalk | Kohlenstoffdioxid | hartes kristrallines |
| in Mörtel | aus der Luft | Claciumcarbonat |
Da der Kalkmörtel zum Abbinden Kohlenstoffdioxid aus der Luft benötigt, wird er auch als Luftmörtel bezeichnet.
Er unterscheidet sich grundlegend von Zementmörtel, der als wesentliche Bestandteile Calcium-, Aluminium- und Eisensilikate enthält und auf andere Art und Weise aus Zement hergestellt wird.
Calciumhydroxid wird auch vielfach zur Neutralisation in der chemischen Industrie eingesetzt, da es die billigste in großen Mengen verfügbare Lauge ist.

