Wichtige anorganische Basen
Basen sind Verbindungen, die bei chemischen Reaktionen Protonen aufnehmen. In wässrigen Lösungen bilden sie Hydroxid-Ionen und wirken demzufolge stark ätzend.
Die wichtigsten anorganischen Basen sind Natriumhydroxid, Kaliumhydroxid und Ammoniak. Diese Basen und ihre wässrigen Lösungen, die Laugen, finden nicht nur Einsatz in der Industrie und Technik, sondern sind auch Bestandteile vieler Gebrauchsgüter des alltäglichen Lebens. So sind z. B. viele Reinigungsmittel alkalisch, da sich Fette und andere Verschmutzungen durch Basen leicht lösen lassen. Industriell sind Basen wichtige Ausgangsstoffe für die Herstellung von Gläsern, Zellstoff, Düngemitteln oder Baustoffen.
Anorganische Basen schädigen die Umwelt, wenn Abwässer zu stark mit alkalischen Reinigungsmitteln oder Chemieabfällen belastet sind und dadurch das pH-Gleichgewicht in Gewässern gestört wird.
Basen sind nach J. N. BRÖNSTED Protonenakzeptoren, d. h. Stoffe, die in chemischen Reaktionen Protonen aufnehmen. In Wasser bilden sie auf diese Weise Hydroxid-Ionen und reagieren deshalb alkalisch bzw. basisch. Die wässrigen Lösungen der Basen nennt man auch Laugen.
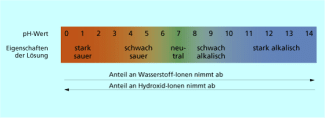
Metallhydroxide sind Ionenverbindungen, deren Gitter aus Metall-Kationen und Hydroxid-Ionen aufgebaut ist. Die Alkalihydroxide sind sehr gut in Wasser löslich und damit vollständig beim Auflösen dissoziiert. Sie sind somit starke Basen. Die Hydroxide mehrwertiger Kationen sind meist schwerer löslich und daher schwächere Basen. Der pH-Wert basischer Lösungen liegt je nach Konzentration und Stärke der Basen zwischen 7 und 14 (Bild 2). Die Lösungen des Natriumhydroxids färben Unitest intensiv blau. Je nach Konzentration der Hydroxid-Ionen wirken Basen teilweise sehr stark ätzend. Sorgloser Umgang mit den Laugen kann daher zu schweren Unfällen führen.
Die wichtigsten anorganischen Basen sind Natriumhydroxid, Kaliumhydroxid, Ammoniak und die Hydroxide der Erdalkalimetalle Calcium und Barium.
-
Der pH-Wert basischer Lösungen liegt zwischen 7 und 14.
Natriumhydroxid
Natriumhydroxid (NaOH) ist eine weiße kristalline Substanz, die auch Ätznatron genannt wird. Die Verbindung wirkt auf der Haut, auf Schleimhäuten und für die Augen ätzend. Natriumhydroxid löst sich unter Wärmeentwicklung gut in Wasser und Alkohol. Es handelt sich um eine hygroskopische ( = Wasser anziehende) Substanz. Die wässrige Lösung wird Natronlauge genannt.
Festes Natriumhydroxid reagiert auch mit dem Kohlenstoffdioxid der Luft zu Natriumcarbonat, daher sollte es gut verschlossen gelagert werden. Diese Reaktion wird bei der organischen Elementaranalyse genutzt, indem das bei der Verbrennung entstandene Kohlenstoffdioxid an Natronkalk gebunden wird.
-
Natriumhydroxid zieht Wasser an.

Natronlauge wird durch Elektrolyse von Natriumchloridlösung (Kochsalzlösung) hergestellt.
Das großtechnisch bedeutendste Verfahren ist die Chlor-Alkali-Elektrolyse, bei der mit Natronlauge und Chlor zwei sehr wichtige Grundstoffe der chemischen Industrie gewonnen werden. Dabei wird an einer Anode aus Titan Chlorid zu Chlor oxidiert, während an einer Eisenkatode Wasserstoff gebildet wird.
In der wässrigen Lösung bleiben Natrium- und Hydroxid-Ionen zurück, es handelt sich um Natronlauge.
Die Natrium-Ionen sind zwar in der Lösung vorhanden, aber an der eigentlichen Reaktion nicht beteiligt:
Damit sowohl eine Reaktion der Hydroxid-Ionen mit dem gebildeten Chlor als auch die Entstehung eines Chlorknallgasgemisches aus Wasserstoff und Chlor verhindert werden, müssen der Anoden- und der Katodenraum getrennt werden. Dafür stehen unterschiedliche Verfahren zur Verfügung.
Jährlich werden ca. 50 Millionen Tonnen Natronlauge hergestellt und in der Industrie vielseitig eingesetzt. So benötigt man große Mengen an Natronlauge zum Aufschließen von Bauxiterz, welches zur Aluminiumgewinnung nötig ist.
Bauxit enthält neben 50 bis 60 % Aluminiumoxid noch Eisenoxid, Silicate und andere Begleitstoffe. Das Aluminiumoxid kann man mit konzentrierter Natronlauge in Form des löslichen Tetrahydroxoaluminat-Komplexes aus Bauxit herauslösen und so von den anderen Oxiden abtrennen. Diese sind in Natronlauge unlöslich. Aus der Aluminatlösung wird durch Verdünnen wieder Aluminiumoxid ausgefällt. Mittels Schmelzflusselektrolyse gewinnt man daraus dann Aluminium. In vielen Bereichen des Alltags wird Aluminium als rostfreies und besonders leichtes Metall eingesetzt.
Auch zur Herstellung von Papier und Cellulose aus Holz oder für die Seifen- und Farbstoffindustrie ist Natronlauge eine unersetzliche Hilfschemikalie, die bei vielen Umwandlungs-, Verarbeitungs-, und Reinigungsprozessen eine Rolle spielt.
Bei vielen Alltagsgegenständen wie Taschentuch, Seife oder Baumwollshirt erkennt man auf den ersten Blick gar nicht, dass Natronlauge nötig war, um diese Sachen herzustellen.
Auch in der Fotografie oder beim Backen von Laugengebäck wird Natronlauge verwendet. Beispielsweise wird das sogenannte Laugengebäck vor dem Backen in eine verdünnte Natriumhydroxidlösung getaucht. Beim Backen ergibt sich dadurch die schöne braune Färbung.
Kaliumhydroxid
Kaliumhydroxid ist wie Natriumhydroxid eine Ionenverbindung. Die Verbindung ist gut wasserlöslich.
Seine wässrige Lösung, die Kalilauge, hat ähnliche Eigenschaften wie die Natronlauge und wird wegen ihrer stark ätzenden Wirkung für Haut und Augen auch als Ätzkali bezeichnet.
Früher wurde Kaliumhydroxid durch die Umsetzung von Pottasche (Kaliumcarbonat) mit gelöschtem Kalk (Calciumhydroxid) hergestellt:
Heute wird Kalilauge ähnlich wie Natronlauge durch die Chlor-Alkali-Elektrolyse von Kaliumchlorid-(KCl)-Lösung hergestellt. Im Gegensatz zu Natriumchlorid, das in den entsprechenden Steinsalzlagerstätten mit Gehalten von über 99 % vorkommt, liegt der Gehalt an Kaliumchlorid in den Kalisalzlagerstätten nur bei 10 bis 40 %. Die hauptsächlichen Begleitsalze sind Natriumchlorid und Magnesiumsalze. Diese müssen vom Kaliumchlorid aufwendig abgetrennt werden. Dadurch hat Kaliumchlorid einen wesentlich höheren Rohstoffpreis als Natriumchlorid. Somit ist dann auch Kalilauge erheblich teurer als Natronlauge und wird folglich in geringerem Umfang produziert.
Kaliumhydroxid findet Verwendung als Trocknungs- und Absorptionsmittel, bei der Herstellung weicher Seifen (Schmierseifen), als Wasser enthärtende Kaliumphosphate für flüssige Waschmittel, bei Farbstoffsynthesen, bei der Entwicklung von Filmen und bei der Herstellung anderer Kaliumverbindungen. Verdünnte Kalilauge wird in der Medizin für äußere Ätzungen eingesetzt.
Calciumhydroxid (Löschkalk)
Calciumhydroxid ist ein weißes, amorphes, ätzendes Pulver, das sich in Wasser schlecht löst (ca. 1,3 g/l bei 20 °C). Kalkwasser nennt man die filtrierte wässrige Lösung, die sehr stark basisch reagiert. Sie kann als Nachweisreagenz für Kohlenstoffdioxid eingesetzt werden, da bei der Durchleitung von Kohlenstoffdioxid-haltiger Luft schwer lösliches Calciumcarbonat in Form winziger Kristalle ausfällt.
Calciumhydroxid wird durch die Umsetzung von Calciumoxid (Branntkalk) mit Wasser hergestellt. Diese Reaktion bezeichnet man als Kalklöschen.
Die Einsatzbandbreite der billigen Base Calciumhydroxid ist äußerst vielfältig und seit langem bekannt. Bereits die Römer benutzten die Suspension von Calciumhydroxid in Kalkwasser (Kalkmilch) zum Weißen von Wänden.
Am bekanntesten ist die Herstellung von Kalkmörtel; durch einen Brei aus in Wasser gelöstem Calciumhydroxid und drei Teilen Sand wird Luft gepresst. Mit dem Kohlenstoffdioxid der Luft bildet sich der harte, kristalline Kalk, . Darüber hinaus wird Calciumhydroxid technisch zur Rauchgasentschwefelung in Kraftwerken, als Bindemittel für wasserlösliche Farben, bei der Zuckergewinnung aus Zuckerrüben und als Zusatz von Düngemitteln verwandt.
Bariumhydroxid
Bariumhydroxid ist ein weißes, kristallines, ätzendes und giftiges Pulver. Die Verbindung liegt in den zwei Formen und (Octahydrat) vor, da das Octahydrat aus der wässrigen Lösung (Barytwasser) leicht kristallisiert. Bariumhydroxid und sein Octahydrat sind extrem giftige Substanzen. Im Gegensatz zu den Calcium- und Strontiumhydroxiden sind beide Verbindungen leicht in Wasser löslich.
Bariumhydroxid wird durch Umsetzung von Bariumoxid mit Wasser unter starker Wärmeentwicklung hergestellt.
Barytwasser nennt man die stark alkalisch reagierende wässrige Lösung des Bariumhydroxids. Es kann ebenso wie Kalkwasser zum Nachweis für Kohlenstoffdioxid eingesetzt werden
Außerdem findet Bariumhydroxid Verwendung bei der Wasseraufbereitung, in der Malerei als Aufschlussmittel für Casein, in der Keramik, bei der Glasmalerei, als Zusatz bei der Herstellung von PVC-Stabilisatoren und Spezialseifen und als Nachweismittel für Carbonate und Sulfate anderer Elemente.
Ammoniak
Ammoniak ist farblos, gasförmig, mit charakteristischem Geruch, und gut wasserlöslich. Die wässrige Lösung reagiert basisch, da die Brönsted-Base Ammoniak dem Wasser ein Proton entzieht und damit Hydroxid-Ionen in der Lösung vorliegen:
NH3 + H2O NH4 + + OH-
Ammoniak ist deshalb technisch so bedeutsam, weil daraus viele andere Stickstoffverbindungen hergestellt werden. Es wird ausschließlich nach dem 1913 entwickelten Haber-Bosch-Verfahren gewonnen. Ammoniak dient zur Herstellung von Düngemitteln, Kunststoffen und Pflanzenschutzmitteln. Außerdem wird es als Kältemittel in Kühlkreisläufen eingesetzt.

