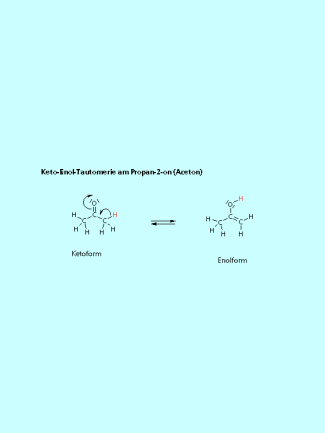
Keto-Enol-Tautomerie
Die Keto-Enol-Tautomerie ist eine spezielle Form der Isomerie. Die Isomerisierung ist eine Gleichgewichtsreaktion, bei der ein Proton vom -Kohlenstoffatom des Keton zum Sauerstoffatom der Keto-Gruppe wandert. Die C=O-Doppelbindung wird aufgelöst und dafür eine C=C-Doppelbindung zwischen dem -Kohlenstoffatom und dem Kohlenstoffatom der Keto-Gruppe gebildet. Keton und Enol sind Konstitutionsisomere.
Die Keto-Enol-Tautomerie ist ein Spezialfall der Konstitutionsisomerie. Konstitutionsisomere können normalerweise nicht einfach in einander überführt werden. Im Gegensatz dazu stellt sich bei Ketonen in Abhängigkeit der Struktur und des Lösungsmittels ein Gleichgewicht mit dem entsprechenden Keton ein.
Zum Begriff
Als Ketone bezeichnet man Verbindungen mit einer Keto-Gruppe, also einem sp-hybridisiertem Kohlenstoffatom mit einer Doppelbindung zu einem Sauerstoffatom. Am Kohlenstoffatom befinden sich noch zwei Substituenten, die mit einem Kohlenstoffatom beginnen, also organische Reste (R) tragen. Der Name Enol lässt schon Rückschlüsse auf die Struktur zu. Der Stammname En- kommt von einem Alken und an der Doppelbindung befindet sich eine Hydroxy-Gruppe -ol. Da die Hydroxy-Gruppe an ein sp-hybridisiertes Kohlenstoffatom gebunden ist sind. Enole keine Alkohole.
Die Keto-Enol-Tautomerie
Die Keto-Enol-Tautomerie kann nur dann beobachtet werden, wenn an eines der beiden -Kohlenstoffatome des Ketons mindestens ein Wasserstoffatom gebunden ist. Am Benzophenon (Diphenylmethanon) gibt es also keine Keto-Enol-Tautomerie.
Bei der Keto-Enol-Tautomerie wandert ein Proton von einem -Kohlenstoffatom an das Sauerstoffatom. Gleichzeitig bildet sich zwischen dem Kohlenstoffatom der ehemaligen Keto-Gruppe und diesem -Kohlenstoffatom eine C=C-Doppelbindung aus.
-
Keto-Enol-Tautomerie, gezeigt am Beispiel von Aceton (Propan-2-on).
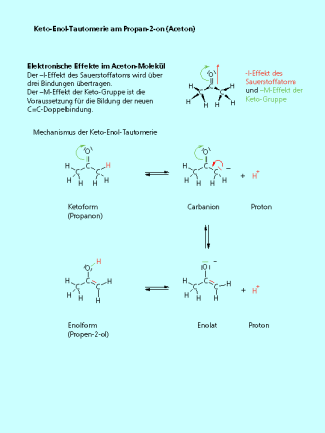
Warum findet diese Reaktion statt?
Das Sauerstoffatom der Keto-Gruppe übt auf das Kohlenstoffatom einen -I-Effekt aus. Dieser "Elektronenzug" wird teilweise auf die beiden -Kohlenstoffatome und auch auf die C-H-Bindungen übertragen. Die Folge ist eine Polarisierung der C-H-Bindung an den -Kohlenstoffatomen, die Bindung wird geschwächt und das Wasserstoffatom wird acider. Acider heißt, es kann leichter als Proton abgespalten werden. Die Keto-Gruppe hat einen -M-Effekt. Dadurch kann die C=O-Doppelbindung aufgelöst und die neue C=C-Doppelbindung gebildet werden.
Wird das Proton abgespalten verbleibt am -Kohlenstoffatom das ehemalige Bindungselektronenpaar also eine negative Ladung (Bild 2). Es sind Proton und Carbanion entstanden. Das Carbanion hat zwei Möglichkeiten. Bindet es das Proton wieder, findet einfach die Rückreaktion statt. Es kann aber auch mit dem freien Elektronenpaar eine Doppelbindung zum Kohlenstoffatom der Keto-Gruppe ausbilden. Durch den -M-Effekt des Sauerstoffatoms wird die C=O-Doppelbindung aufgelöst und das ehemalige Bindungselektronenpaar befindet sich am Sauerstoffatom. Folgerichtig hat das Sauerstoffatom jetzt eine negative Ladung. Die Verbindung wird als Enolat bezeichnet. In der Lösung befindet sich immer noch das abgespaltene Proton. Wenn dieses mit dem negativ geladenen Sauerstoffatom eine Bindung bildet entsteht eine Hydroxy-Gruppe und wir haben das Enol.
Katalysatoren der Keto-Enol-Tautomerie
Da im ersten Schritt des Reaktionsmechanismus ein Proton vom -Kohlenstoffatom abgespalten wird, katalysieren BRÖNSTED-Basen die Enol-Bildung. Durch die Base wird das Proton im ersten Gleichgewicht entfernt. Dadurch verschiebt sich die Lage dieses Gleichgewichtes zu Gunsten des Carbanions. Auch BRÖNSTED-Säuren katalysieren die Enol-Bildung. Das Proton greift am Sauerstoffatom der Keto-Gruppe an. Dadurch entsteht ein Kation. Die Ladung verteilt sich zwischen dem Sauerstoffatom und dem Kohlenstoffatom der Keto-Gruppe. Durch die Abspaltung eines Protons an einem -Kohlenstoffatom kann sich sofort die C=C-Doppelbindung des Enols bilden.
-
Elektronische Effekte im Aceton als Ursche für die Keto-Enol-Tautomerie.
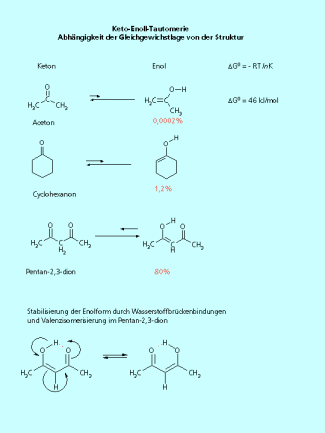
Liegt die Verbindung als Keton oder als Enol vor?
Die Gleichgewichtslage hängt stark von der Struktur ab. Das Pentan-2,3-dion liegt zu 80 % als Enol vor. Die Ursache ist die Bildung eines "Sechsringes" durch die Wasserstoffbrückenbindung. Eine zusätzliche Stabilisierung erfolgt durch die Valenzisomerisierung. Einfache Ketone liegen bevorzugt in der Ketoform vor. Zu bemerken ist noch, dass auch Aldehyde einer Keto-Enol-Tautomerie unterliegen.
-
Die Laghes des Gleichgewichtes bei der Keto-Enol-Tautomerie ist abhängig von der Molekülstruktur.
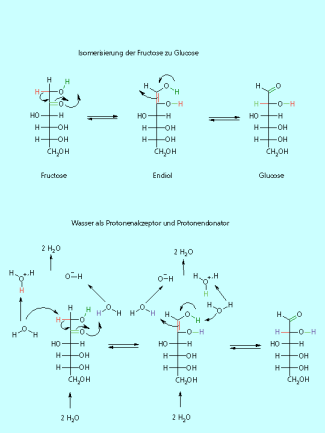
Die Umwandlung von Fructose in Glucose
Im Stoffwechselprozess wird Fructose in Glucose umgewandelt. Die Grundlage dieser Reaktion ist die Keto-Enol-Tautomerie. Aus der Fructose bildet sich dabei das Endiol. Für die Rückreaktion gibt es zwei Möglichkeiten. Die Rückbildung der Keto-Gruppe am C-2 führt wieder zur Fructose. Die Bildung einer Carbonyl-Gruppe am C-1 ergibt die Glucose. Bei dieser Reaktion wird aus der Enol-Struktur ein Aldehyd gebildet. Die Reaktion wird durch Enzyme katalysiert, als Base fungiert der Ampholyt Wasser. Das Wasser "transportiert" also das Proton. Dazu werden zwei Moleküle Wasser benötigt. Bei dieser Reaktion ist das Wasser-Molekül sowohl Protonenakzeptor als auch Protonendonator.
-
Über Keto-Enol-Gleichgewichte wandeln sich Glucose und Fructose ineinander um.