Nachweis von Ammonium-Ionen
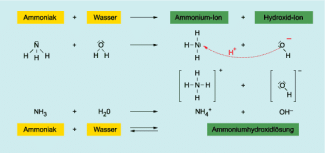
Ammoniak ist an seinem typischen, stechenden Geruch zu erkennen. Außerdem reagieren Ammoniak und Wasser in einer Protolysereaktion zu Ammonium-Ionen und negativ geladenen Hydroxid-Ionen.
Letztere färben Universalindikatoren blau, die Färbung gilt als indirekter Nachweis für Ammoniak und Ammonium-Ionen.
Aufgabe:
Weise Ammoniak und Ammonium-Ionen nach!
(Das Experiment ist nur nach Anweisung des Lehrers durchzuführen!)
Vorbetrachtungen:
Viele Ionen können durch Farbreaktionen nachgewiesen werden. Farbreaktionen sind chemische Reaktionen, bei denen durch Reaktion von verschiedenen Lösungen bzw. durch sogenannte Farbindikatoren eine typische Farbänderung auftritt.
Farbindikatoren werden häufig zum Nachweis von Säuren oder Basen genutzt. Es sind organische Stoffe, deren Farbe von der Konzentration der Wasserstoff- und der Hydroxid-Ionen abhängt.
Das Ammonium-Ion bildet sich bei der Reaktion von Ammoniak mit Wasser. Bei dieser Reaktion entstehen einfach positiv geladene Ammonium-Ionen und Hydroxid-Ionen.
Bei Zugabe von konzentrierter Natriumhydroxidlösung zu einer festen Stoffprobe, die Ammonium-Ionen enthält, entsteht Ammoniak, das am chararkteristischen Geruch erkennbar ist.
Vorbereitung:
Geräte:
Reagenzgläser, 2 Uhrglasschalen, Pipette, Schutzbrille
Chemikalien:
Untersuchungssubstanz (z. B. Ammoniumchlorid), konzentrierte Natriumhydroxidlösung, Indikatorpapier (Unitest, Lackmus)
Nachweis des Ammoniaks:
Durchführung:
Ein angefeuchtetes Indikatorpapier wird über ein Reagenzglas mit konzentrierter Ammoniaklösung gehalten.
Beobachtung:
Das angefeuchtete Indikatorpapier färbt sich blau.
-
Reaktion von Ammoniak und Wasser
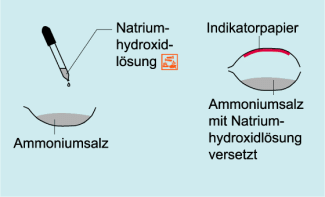
Nachweis von Ammonium-Ionen:
Durchführung:
Zu einer Stoffprobe eines Ammoniumsalzes (z. B. Ammoniumchlorid) wird konzentrierte Natriumhydroxidlösung auf einer Uhrglasschale getropft.
Vorher wird an der Innenseite einer zweiten Uhrglasschale ein Streifen angefeuchtetes Indikatorpapier angeheftet. Die untere Uhrglasschale wird mit der zweiten abgedeckt! (Achte darauf, dass das Indikatorpapier nicht mit den Chemikalien in Berührung kommt!)
Der Geruch wird (durch Zufächeln) nach dem Versetzen mit ein paar Tropfen Natriumhydroxidlösung geprüft.
-
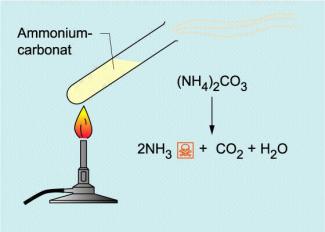
Ammoniumcarbonat wird thermisch zersetzt, wobei Ammoniak entsteht. Die meisten anderen Ammoniumsalze können jedoch nicht durch thermische Zersetzung nachgewiesen werden!
Beobachtungen:
Bei Zugabe von konzentrierter Natriumhydroxidlösung zu einer festen Stoffprobe, die Ammonium-Ionen enthält, entsteht Ammoniak. Dieses ist am charakteristischen Geruch erkennbar. Das Indikatorpapier färbt sich blau.
Auswertung:
Ammoniak als Stoff wird nicht direkt nachgewiesen, sondern kann entweder über den charakteristischen Geruch wahrgenommen werden, oder indirekt über die Bildung von Hydroxid- Ionen nachgewiesen werden.
Bei der Zugabe von Natriumhydroxid zu einem Ammoniumsalz entsteht Ammoniak. Das entstehende Ammoniak verflüchtigt sich und ist an seinem typischen, stechenden Geruch zu erkennen.
Ammoniak reagiert mit dem Wasser des feuchten Indikatorpapiers zu Hydroxid- Ionen und Ammonium- Ionen. Die Hydroxid- Ionen führen zur Blaufärbung des Unitestpapiers.
Ammoniumcarbonat kann man auch thermisch zu Ammoniak, Kohlenstoffdioxid und Wasser zersetzen. Über das Erhitzen von Ammoniumcarbonat lässt sich auf diese Weise mit angefeuchtetem Indikatorpapier Ammoniak nachweisen.
-
Nachweis von Ammonium-Ionen