Nachweis von Carbonat-Ionen
Carbonat-Ionen werden durch eine Fällungsreaktion nachgewiesen.
Dabei wird die Eigenschaft der Carbonat-Ionen genutzt, dass sie bei Zugabe von Säuren in Kohlenstoffdioxid und Wasser zerfallen. Das gebildete Kohlenstoffdioxid reagiert mit Calciumhydroxid- oder Bariumhydroxidlösung zu schwer löslichem Calcium- oder Bariumcarbonat.
Aufgabe:
Weise Kohlenstoffdioxid in der Luft oder Carbonat-Ionen in Feststoffen nach! (Das Experiment ist nur nach Anweisung des Lehrers durchzuführen!)
Vorbetrachtungen:
1. Fällungsreaktionen
Fällungsreaktionen werden häufig zum Nachweis von Ionen benutzt. Dabei treten Ionen der Lösung des Nachweismittels mit Ionen der Lösung des zu prüfenden Stoffes zusammen und bilden schwer lösliche Salze.
2. Carbonat- Ionen
Das Carbonat-Ion ist das Säurerest-Ion der Kohlensäure, . Carbonate zerfallen beim Erhitzen in das Metalloxid und Kohlenstoffdioxid.
Durch Säuren werden Carbonate unter Bildung von Wasser und Kohlenstoffdioxid zersetzt.
3. Kohlenstoffdioxid
Kohlenstoffdioxid ist unter Normalbedingungen ein Gas, das bei -78,5°C fest wird, ohne sich vorher zu verflüssigen.
Festes Kohlenstoffdioxid wird auch als Trockeneis bezeichnet.
Das Gas ist geruchlos, schwerer als Luft und farblos.
Kohlenstoffdioxid wird als Kühlmittel in Form von dem Trockeneis und als Löschmittel in Feuerlöschern eingesetzt. In Erfrischungsgetränken ruft das Kohlenstoffdioxid („Kohlensäure“) die Gasbläschen – das Prickeln –hervor.
Vorbereitung:
Geräte:
Reagenzgläser, Reagenzglas mit seitlichem Ansatz, Pipette, Stopfen, Gummischlauch, Gaseinleitungsröhrchen,
Chemikalien:
Probesubstanz, Calciumhydroxidlösung oder Bariumhydroxidlösung, verdünnte Salzsäure, destilliertes Wasser
-
Das Kohlenstoffdioxid aus der Atemluftt führt zu einem weißen Niederschlag in der Calciumhydroxidlösung. Vorsicht! Es darf keine Calciumhydroxidlösung in den Mund gelangen!
Durchführung:
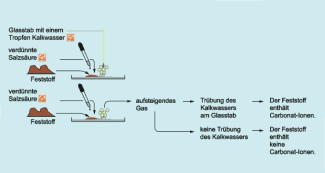
1. Die auf Carbonat-Ionen zu untersuchende Substanz wird in ein Reagenzglas mit seitlichem Ansatzrohr gegeben.
Der seitliche Ansatz des Reagenzglases wird mit einem Gaseinleitungsrohr verbunden.
Das Gaseinleitungsrohr wird in ein zweites Reagenzglas geführt, das mit Calciumhydroxidlösung oder Bariumhydroxidlösung gefüllt ist.
Auf die zu untersuchende Substanz wird verdünnte Salzsäure getropft.
Das erste Reagenzglas wird verschlossen, sodass das Gas in die Hydroxidlösung eingeleitet wird.
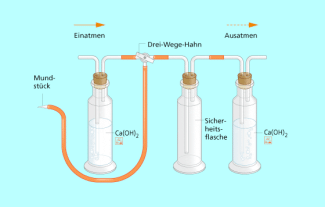
2. Man verbindet zwei Gaswaschflaschen miteinander mit einem Schlauch und füllt in die zweite Flasche Calciumhydroxidlösung oder Bariumhydroxidlösung . Nun bläst man man durch die leere Sicherheitsflasche ausgeatmetet Luft in die Hydroxidlösung in der zweiten Flasche.
Beobachtung:
1. Im ersten Reagenzglas entstehen Blasen, die das Entweichen eines Gases anzeigen. Beim Einleiten dieses Gases in Calciumhydroxid- oder Bariumhydroxidlösung entsteht eine weiße Trübung. Die weiße Trübung setzt sich als Niederschlag ab, es ist ein schwer löslicher Stoff entstanden.
2. In der zweiten Flasche bildet sich ein weißer Niederschlag in der Hydroxidlösung.
Auswertung:
Zum Nachweis von Kohlenstoffdioxid und Carbonat-Ionen wird die Bildung eines schwer löslichen Salzes genutzt.
Beim Nachweis von Carbonat-Ionen in einem festen Stoff wird die Eigenschaft der Carbonat-Ionen verwendet, dass sie bei Zugabe von Säuren in Kohlenstoffdioxid und Wasser zerfallen.
Durch das Zutropfen von Salzsäure entsteht Kohlenstoffdioxid, das über das Gaseinleitungsohr in die Calciumhydroxidlösung oder Bariumhydroxidlösung eingeleitet wird.
In der Lösung reagiert das Kohlenstoffdioxid (das auch in der Atemluft in höheren Konzentrationen enthalten ist) zu schwer löslichen Calciumcarbonat oder Bariumcarbonat, wodurch sich die Lösung trübt.
Dieses schwer lösliche Calciumcarbonat (oder Bariumcarbonat) bewirkt die weiße Trübung der Lösung.
Weil Bariumsalze Gefahrstoffe sind, ist der Nachweis mit Calcium-Ionen ungefährlicher. Allerdings kann es hier dazu kommen, dass sich der Niederschlag unter Bildung von Calciumhydrogencarbonat wieder löst.
-
Nachweis von Carbonat-Ionen in einer festen Substanz