Nachweis von Nitrat-Ionen
Nitrat-Ionen können durch verschiedene chemische Reaktionen mit entsprechenden Teststreifen nachgewiesen werden. Außerdem nutzt man zum Nitrat-Nachweis die „Ringprobe“, eine charakteristische Farbreaktion mit Eisen(II)-sulfatlösung und konzentrierter Schwefelsäure.
Aufgabe:
Weise Nitrat-Ionen nach und informiere dich über die ablaufenden Reaktionen. (Die Ringprobe darf nur durch den Lehrer durchgeführt werden!)
-
Nachweis von Nitrat-Ionen durch die "Ringprobe"

Heinz Mahler, Berlin
Vorbetrachtungen:
Nitrat-Ionen können durch verschiedene Farbreaktionen oder mit speziellen Teststreifen nachgewiesen werden. Bei der Ringprobe wird konzentrierte Schwefelsäure benutzt (VORSICHT! Stark ätzend!)
Vorbereitung:
Geräte:
Reagenzglas, Reagenzglasständer, Pipette, Schutzbrille
Chemikalien:
frisch bereitete gesättigte Eisen(II)-sulfat-Lösung, verdünnte Schwefelsäure , konzentrierte Schwefelsäure, Probesubstanz
Durchführung mit Beobachtung:
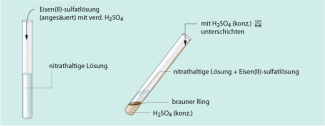
5 Tropfen der zu untersuchenden Lösung werden in das Reagenzglas gegeben.
Es werden 5 Tropfen frisch bereiteter Eisen(II)-sulfat-Lösung hinzugefügt.
Mit 2 Tropfen verdünnter Schwefelsäure wird das Stoffgemisch angesäuert. (Vorsicht!)
Mit konzentrierter, öliger Schwefelsäure (ca. 4 Tropfen) wird das Stoffgemisch unterschichtet (Vorsicht! konzentrierte Schwefelsäure ist stark ätzend!), indem man die Schwefelsäure im schräg gehaltenen Reagenzglas an der Wand hinablaufen lässt.
Aufgrund ihrer höheren Dichte setzt sich die Schwefelsäure unter der bereits vorhandenen Lösung ab und bildet eine Grenzschicht.
Beobachtung:
Es entsteht ein Ring mit einer violetten bis braunen Färbung an der Grenzschicht. Der Ring entsteht nur, wenn Nitrat-Ionen enthalten sind.
Auswertung:
Zum Nachweis von Nitrat-Ionen wird die Bildung eines farbigen Komplexes (Pentaaquanitrosyleisen(II)-sulfat) genutzt.
Die braune Färbung wird durch die Bildung von Stickstoffmonooxid (NO) hervorgerufen, das im Komplex an Fe(II)-Ionen gebunden ist. Das NO entsteht durch Reduktion von Nitrat durch Fe(II) in schwefelsaurer Lösung nach folgender Reaktion.
Da sich die farbige Komplexverbindung an der Grenzschicht sich als brauner Ring zeigt, wird der Nachweis auch als „Ringprobe“ bezeichnet.
Fehlerbetrachtung:
Dieses Experiment ist schwierig und funktioniert nicht immer.
Zum einen sollte vorher das Unterschichten geübt werden, da dieser Vorgang für das Experiment sehr wichtig ist.
Der erste Grund, weshalb dieses Experiment nicht funktioniert, liegt an der Eisen(II)-sulfat-Lösung.
Diese muss immer vor dem Experiment frisch zubereitet werden, da sich die Eisen(II)-Ionen der Lösung schnell in Eisen(III)-Ionen umwandeln.
Dieses Experiment ist auch ungünstig, wenn die Probelösung farbig ist.
Des Weiteren darf nicht stark geschüttelt werden, weil der hauchdünne Ring aus dem gebildeten Komplex zerstört wird.
Indirekter Nachweis von Nitrat
Eine andere Möglichkeit des Nitrat-Nachweises besteht darin, dass man Nitrat mit Zink und Salzsäure zu Nitrit NO2- reduziert. Nitrit kann dann mit „Lunges Reagenz“ nachgewiesen werden.
-
Durchführung der "Ringprobe"