Ordnungszahl und Massenzahl
Atomkerne lassen sich durch die Anzahl der Kernbausteine (Nukleonen) Proton und Neutron charakterisieren. Die Protonenzahl ist identisch mit der Ordnungszahl im Periodensystem der Elemente. Die Massenzahl ergibt sich aus Protonenzahl und Neutronenzahl. Zur übersichtlichen Kennzeichnung eines Atomkerns verwendet man die Symbolschreibweise.
Charakterisierung von Atomkernen
Atomkerne sind aus den Kernbausteinen Protonen und Neutronen aufgebaut. Diese Kernbausteine werden als Nukleonen bezeichnet. Die Massenzahl A ist die Anzahl der Nukleonen im Atomkern. Sie ergibt sich aus der Anzahl der Protonen Z und der Anzahl der Neutronen N:
A = Z + N
Dabei gilt:
- Die Anzahl der Protonen im Atomkern ist gleich der Ordnungszahl im Periodensystem der Elemente. Sie wird auch als Kernladungszahl bezeichnet, da die Anzahl der Protonen die Ladung des Kerns bestimmt.
- Die Anzahl der Neutronen im Atomkern ergibt sich als Differenz aus der Massenzahl und der Protonenzahl.
So hat z. B. das Nuklid des Natriums (Ordnungszahl 11) eine Massenzahl von 23. Das bedeutet:
- Die Anzahl der Protonen im Atomkern (Kernladungszahl) beträgt 11 (= Ordnungszahl).
- Die Anzahl der Nukleonen (Protonen + Neutronen) beträgt 23.
- Die Anzahl der Neutronen ergibt sich aus Massenzahl und Protonenzahl:
N = A - Z
N = 23 - 11
N = 12
Im betreffenden Atomkern befinden sich 12 Neutronen.
- Bei einem neutralen Atom ist darüber hinaus die Anzahl der Elektronen in der Atomhülle gleich der Anzahl der Protonen im Atomkern. Ein neutrales Natriumatom hat folglich 11 Elektronen in der Atomhülle.
- Atome eines Elements mit gleicher Kernladungszahl, jedoch mit einer unterschiedlichen Anzahl an Neutronen im Kern und damit eine unterschiedliche Massezahl bezeichnet man als Isotope.
-
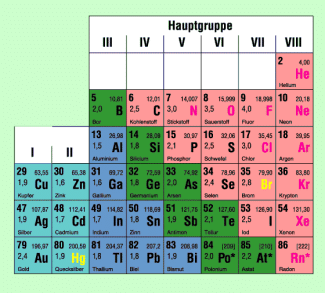
Ausschnitt aus dem Periodensystem der Elemente
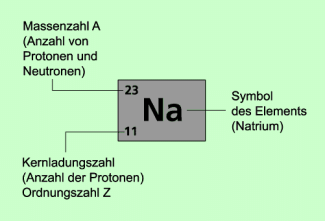
Symbolschreibweise
Um einen Atomkern in kurzer und übersichtlicher Form kennzeichnen zu können, verwendet man häufig die Symbolschreibweise. Manchmal setzt man auch die Massenzahl hinter den Namen des Elements oder hinter das chemische Symbol und schreibt beispielsweise:
Natrium-23 oder Na-23
Der Bindestrich wird mitunter auch weggelassen. Die Schreibweise lautet dann:
Natrium 23 oder Na 23
-
Symbolschreibweise
Die Symbolschreibweise wird nicht nur zur Kennzeichnung von Atomkernen verwendet, sondern auch zu der von Elementarteilchen genutzt.
bedeutet, dass ein Elektron (Symbol e) einfach negativ geladen ist, also die Elementarladung trägt und seine Masse vernachlässigbar klein (= 0) ist. Eine Übersicht über die Symbolschreibweise einiger Elementarteilchen gibt Bild 3.
-
Symbolschreibweise für Elementarteilchen


