Organische Reaktionen
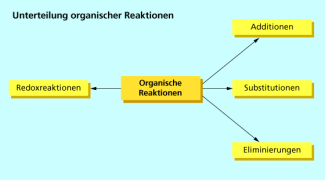
Chemische Reaktionen werden nach verschiedenen Gesichtspunkten unterteilt. Bei organischen Reaktionen werden fast immer Atombindungen gespalten und wieder neu geknüpft, sodass sich die Unterteilung von der Unterteilung anorganischer Reaktionen unterscheidet. In der Organik betrachtet man hauptsächlich die Änderung des Bindungszustandes der Kohlenstoffatome und unterscheidet danach zwischen Substitution, Addition und Eliminierung. Aber auch organische Redoxreaktionen spielen eine wichtige Rolle als Nachweisreaktionen und in der Synthesechemie.
Chemische Reaktionen können nach verschiedenen Prinzipien eingeteilt werden. Nach dem Aggregatzustand der reagierenden Stoffe können Gasreaktionen, Reaktionen in wässrigen Lösungen und Reaktionen von Feststoffen unterschieden werden. In Abhängigkeit von der Art der miteinander reagierenden Teilchen bezeichnet man Stoffumwandlungen als Molekülreaktionen, Ionenreaktionen oder Radikalreaktionen.
-
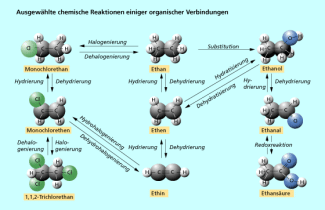
Vielfalt chemischer Reaktionen organischer Verbindungen
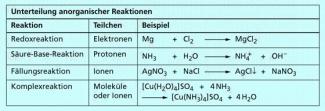
In der anorganischen Chemie unterscheidet man die Reaktionen danach, welche Teilchen zwischen den Ausgangsstoffen ausgetauscht werden:
So sind Redoxreaktionen chemische Reaktionen mit Elektronenübergang. Bei Säure-Base-Reaktionen werden Protonen zwischen den Reaktionspartnern ausgetauscht. Bei Fällungsreaktionen und Reaktionen von Komplexverbindungen sind die ausgetauschten Teilchen Ionen oder Moleküle.
-
Unterteilung anorganischer Reaktionen nach der Art ausgetauschter Teilchen
Bei organischen Reaktionen werden fast immer eine oder mehrere Atombindungen bei den Ausgangsstoffen gespalten und dafür neue Atombindungen bei den Reaktionsprodukten gebildet. Dabei finden oft Elektronenübergänge statt, sodass viele Reaktionen formal Redoxreaktionen sind. Andere Bindungsarten als die Atombindung (z. B. die Ionenbeziehung) spielen in der Organik nur eine untergeordnete Rolle. Es ist daher zweckmäßig, die Vielzahl organischer Reaktionen nach anderen Gesichtspunkten zu unterteilen als die anorganischen Reaktionen.
In der Organik ist vor allem die Änderung des Bindungszustandes der Kohlenstoffatome von Interesse, d. h. hauptsächlich die Anzahl der Atombindungen bzw. Bindungspartner vor und nach der Reaktion. Danach unterscheidet man zwischen Additions-, Substitutions- und Eliminierungsreaktionen. Außerdem ordnet man als Redoxreaktionen vor allem solche Prozesse ein, bei denen Elektronenübergänge an funktionellen Gruppen stattfinden. Die Grenze zwischen Redoxreaktionen und den anderen Reaktionstypen ist jedoch nicht streng definiert.
Substitution
Bei einer Substitution werden Atome oder Atomgruppen zwischen den Ausgangsstoffen ausgetauscht. Die Anzahl der Einfach- und Mehrfachbindungen an den Kohlenstoffatomen bleibt dabei gleich.
Meist entstehen aus zwei Ausgangsstoffen zwei Reaktionsprodukte. Substitutionsreaktionen treten oft bei organischen Stoffen mit Einfachbindungen auf. Es sind also bevorzugte Reaktionen gesättigter Kohlenwasserstoffe wie Alkane oder Halogenalkane. Aber auch aromatische organische Verbindungen wie Benzen oder Phenol gehen vielfach Substitutionsreaktionen ein.
Bei der Halogenierung als Substitution werden Wasserstoffatome gesättigter Kohlenwasserstoffe durch Halogenatome ersetzt.![]()
Kondensationen sind Sonderfälle der Substitution, bei denen kleine Moleküle (oft Wasser) aus organischen Verbindungen abgespalten werden. Ein typisches Beispiel ist die Veresterung von Carbonsäuren. (Hinweis: Streng wissenschaftlich betrachtet findet die Veresterung in mehreren Schritten statt und wird nur formal als Substitutionsreaktion eingestuft.)
Die vielfache Wiederholung der Kondensation nennt man Polykondensation. Dadurch entstehen Polykondensate wie Polyester. Diese sind makromolekulare Stoffe, die als Kunststoffe Anwendung finden.
![]()
-
Unterteilung organischer Reaktionen
Addition
Die Addition ist eine Art der chemischen Reaktion, bei der ein kleineres Molekül an die Doppel- oder Dreifachbindung eines ungesättigten Moleküls angelagert wird. Die Mehrfachbindung wird gespalten und zwei neue Einfachbindungen gebildet. Bei einer Addition entsteht in der Regel kein Nebenprodukt.
Additionen sind die bevorzugten Reaktionen ungesättigter, kettenförmiger Kohlenwasserstoffe. Gesättigte organische Verbindungen verfügen nicht über Mehrfachbindungen und können daher keine Additionsreaktionen eingehen.
Die Hydrierung ist eine Additionsreaktion, bei der unter Anwesenheit von Katalysatoren Wasserstoff an die Mehrfachbindung angelagert wird. Die Halogenierung als Addition ist dagegen die Anlagerung von Elementen der VII. Hauptgruppe an ungesättigte organische Verbindungen. In beiden Fällen verändern sich die Oxidationszahlen der Kohlenstoffatome, sodass es sich formal auch um Redoxreaktionen handelt.![]()
Bei der Hydrohalogenierung werden Halogenwasserstoffe addiert, bei der Hydratisierung Wasser. Beide Additionen sind keine Redoxreaktionen.![]()
-
Die Addition von Brom an ungesättigte Moleküle gilt als Nachweis von Mehrfachbindungen.

Heinz Mahler, Berlin
Polyadditionen und Polymerisationen sind Sonderfälle der Addition, bei denen ungesättigte Verbindungen durch vielfache Wiederholung von Additionsreaktionen zu Makromolekülen reagieren. Beide Reaktionen spielen bei der Herstellung von Kunstoffen eine wichtige Rolle.
Bei der Polymerisation entsteht das Makromolekül (Polymer) aus niedrigmolekularen ungesättigten Molekülen, die man Monomere nennt. Polymerisationsreaktionen verlaufen in drei Teilschritten:![]() Eliminierung
Eliminierung
Die Eliminierung ist eine chemische Reaktion, bei der Atome oder Atomgruppen aus Molekülen abgespalten werden. Dabei wird an zwei benachbarten Kohlenstoffatomen je ein gebundenes Atom oder eine Atomgruppe entfernt und eine Mehrfachbindung ausgebildet. Die Eliminierung ist die Rückreaktion der Addition.
Hauptsächlich Alkane, Halogenalkane und Alkohole können Eliminierungen eingehen, ungesättigte Kohlenwasserstoffe und Aromaten dagegen nicht. Eliminierungen spielen eine wichtige Rolle in der technischen Synthesechemie. Je nach Art des abgespaltenen Moleküls unterscheidet man zwischen Dehydrierung, Dehydratisierung und Dehydrohalogenierung. Bei der Dehydrierung wird Wasserstoff (nicht Wasser !!!) abgegeben, bei der Dehydratisierung Wasser und bei der Dehydrohalogenierung Halogenwasserstoff.
![]()
Redoxreaktionen
Einige Reaktionen organischer Verbindungen lassen sich nicht so einfach in das Schema der Additions-, Substitutions- und Eliminierungsreaktionen einordnen. Dazu zählen z. B. die Reaktionen mit Sauerstoff wie die Verbrennung von Kohlenwasserstoffen. Die Verbrennung ist die klassische Oxidation (Redoxreaktion im engeren Sinn) und wird auch in der Organik als Redoxreaktion bezeichnet. Die stark exotherme Reaktion findet bei der Verbrennung von Kraftstoffen und Heizgasen statt und bildet die Grundlage für die Gewinnung von Wärme (Öl- und Gasheizung) sowie die Fortbewegung der Menschheit mit Kraftfahrzeugen oder Flugzeugen.![]() Auch einige Reaktionen an funktionellen Gruppen sind keine klassischen Additions- oder Substitutionsreaktionen. So lässt sich z. B. die Hydrierung von Nitroverbindungen nur als Redoxreaktion einordnen. Aber auch Aldehyde, Alkohole und Carbonsäuren unterliegen Redoxreaktionen, bei denen die funktionelle Gruppe oxidiert bzw. reduziert wird.
Auch einige Reaktionen an funktionellen Gruppen sind keine klassischen Additions- oder Substitutionsreaktionen. So lässt sich z. B. die Hydrierung von Nitroverbindungen nur als Redoxreaktion einordnen. Aber auch Aldehyde, Alkohole und Carbonsäuren unterliegen Redoxreaktionen, bei denen die funktionelle Gruppe oxidiert bzw. reduziert wird.![]()
![]() Redoxreaktionen finden insbesondere beim Nachweis funktioneller Gruppen in organischen Verbindungen Anwendung. Viele Farbreaktionen z. B. die Reduktion von Cu(II) in fehlingscher Lösung zu Cu(I) oder von Ag(I) in ammoniakalischer Silbernitratlösung zu metallischem Silber beruhen auf Redoxreaktionen.
Redoxreaktionen finden insbesondere beim Nachweis funktioneller Gruppen in organischen Verbindungen Anwendung. Viele Farbreaktionen z. B. die Reduktion von Cu(II) in fehlingscher Lösung zu Cu(I) oder von Ag(I) in ammoniakalischer Silbernitratlösung zu metallischem Silber beruhen auf Redoxreaktionen.

