PET
Polyethylenterephthalat (PET) ist einer der wichtigsten Polyester und gehört zur Gruppe der Polykondensate. Seine große Bedeutung kommt daher, dass er ein vielseitiger Werkstoff mit breitem Einsatzgebiet ist. So wird er als Textilfaser genutzt, und außerdem werden zunehmend Getränkeflaschen aus PET hergestellt. Die Umkehrung der Synthese ermöglicht ein vollständiges Recycling des Werkstoffes, sodass er ökologisch betrachtet anderen Kunststoffen vorzuziehen ist.
Die Entwicklung der Chemiefasern wie Polyester, Polyamide und Polyacryl in der ersten Hälfte des 20. Jahrhunderts führte zu einer Revolution in der Fertigung von Textilien, da nun eine bis dahin unbekannte Vielfalt von besonderen Eigenschaften wie Knitterfreiheit und Formbeständigkeit zur Verfügung stand, die natürliche Fasern wie Baumwolle, Wolle etc. bei weitem nicht bereitstellen konnten. Beispielhaft sei an den Verkauf der ersten Nylonstrümpfe im Jahre 1940 erinnert, als in den USA innerhalb von vier Tagen 4 Millionen Paare über den Ladentisch gingen.
Die Qualität von Chemiefasern wurde in den letzten Jahrzehnten stetig verbessert, und neue Methoden zu ihrer Verarbeitung wurden entwickelt, wie z. B. die Herstellung von Mikrofasern. Polyesterfasern finden heute vielseitige Verwendung, oft in Mischung mit anderen Fasern. Da sie wenig Wasser aufnehmen und schnell trocknen, werden sie häufig in Sportbekleidung verwendet, z. B. in Sportunterwäsche oder zur Herstellung hochwertiger Funktionsjacken.
Zunehmend werden hochspezialisierte Kleidungsstücke aus Chemiefasern hergestellt. Aber nicht nur im textilen Bereich, sondern auch auf allen anderen Gebieten verdrängen synthetische Werkstoffe die traditionellen wie Metalle, Holz und Glas in zunehmendem Maße.
Grundlagen
Der Polyester Polyethylenterephthalat (PET) ist ein glasklarer thermoplastischer Kunststoff mit einer Schmelztemperatur von 265 °C. Er wurde in den Jahren 1939 bis 1946 von Whinfield und Dickson in England entwickelt. Hauptverwendungszweck ist die Erzeugung von Fasern, wofür im Jahr 2008 weltweit rund 30 Mio. t produziert wurden. Textilien auf der Basis dieses Polyesters sind knitterfrei, scheuerfest, form- und chemikalienbeständig sowie lichtecht. Daneben wuden weltweit knapp 13 Mio. t für die Herstellung von Folien und Filmen produziert und seit einigen Jahren in zunehmendem Maße auch Getränkeflaschen. Diese sind zwar weniger kratzfest als Glasflaschen und gegenüber Chemikalien anfälliger, sodass sie schneller verschleißen, haben aber ein wesentlich geringeres Gewicht, wodurch der Energieaufwand für Transport und Verteilung günstiger ist. Zur Beseitigung der Kratzer werden allerdings zurzeit in der Praxis bei großen Getränkeherstellern Poliermaschinen erfolgreich erprobt.
Vorteilhaft aufgrund ihres geringen Gewichtes sind auch Flaschen aus den konkurrierenden Kunststoffen Polyvinylchlorid (PVC) oder Polycarbonat. Bis heute konnte noch nicht geklärt werden, welcher Werkstoff für Getränkeflaschen am besten geeignet ist. PET als Verpackungsmaterial zeichnet sich gegenüber seinen Konkurrenzprodukten wie Polycarbonaten oder Polyvinylchlorid (PVC) durch die außergewöhnliche Kombination folgender Eigenschaften aus:
- hohe chemische und mechanische Beständigkeit (bruchfest)
- geringes spezifisches Gewicht
- transparent (durchsichtig), geschmacksneutral
- gibt keine gesundheitlich bedenklichen Stoffe in die eingefüllten Getränke ab
- hygienisch einwandfrei
- umweltfreundlich zu produzieren (1 l Rohöl reicht aus für 12 PET-Flaschen)
- ökologisch unbedenklich zu deponieren
- sinnvoll zu recyceln
Synthese
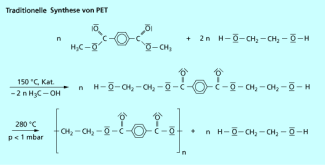
Die traditionelle Polykondensation des Polyethylenterephthalats aus dem Dimethylester der Therephthalsäure und Ethandiol läuft in zwei Schritten ab.
Im ersten Schritt findet bei 150 °C unter Verwendung von Calcium-, Magnesium- oder Zinkacetat als Katalysator eine Umesterung statt, d. h. die Methanolatgruppe wird durch eine Ethandiolatgruppe ersetzt. Das entstehende Methanol wird abdestilliert. Daran schließt sich im zweiten Schritt bei bis zu 280 °C und sehr niedrigem Druck (< 1 mbar) die eigentliche Polykondensation an. Das freiwerdende Ethandiol wird hier ebenfalls abdestilliert.
-
Traditionelle Kondensation von Dimethylterephthalat und Ethandiol
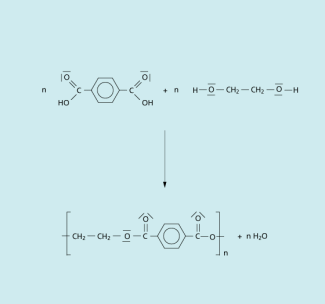
Wegen der vergleichsweise niedrigen Reaktionsgeschwindigkeit der traditionellen Kondensation wird Polyethylenterephthalat großtechnisch zunehmend durch Schmelzkondensation von sehr reiner Terephthalsäure mit Ethandiol (1,2-Dihydroxyethan) in einer Stickstoffatmosphäre unter erhöhtem Druck (2,7-5,5 bar) dargestellt. Das entstehende Wasser wird bei einer Temperatur zwischen 220 und 260 °C aus dem Reaktionsgemisch abdestilliert, wodurch die Ausbeute nach dem Prinzip von LE CHATELIER auf die Seite des Polyesters verschoben wird.
-
Schmelzkondensation von Terephthalsäure und Ethandiol
Recycling
Voraussetzung für das Recycling ist in jedem Fall das Vorliegen von sortenreinen Abfällen, was bei gebrauchten Getränkemehrwegflaschen ohnehin und bei Einwegflaschen über das seit Januar 2003 auch in Deutschland eingeführte Pfandsystem relativ leicht zu bewerkstelligen ist. Es sind prinzipiell zwei Wege des Recyclings denkbar:
- Umschmelzen des Thermoplasten PET zu neuen Gebrauchsgegenständen
- Chemischer Abbau des Polyesters durch Spaltung der Esterbindung und Verwendung der gereinigten Komponenten zur Synthese von neuem PET
Da beim ersten Weg Verunreinigungen des Altmaterials unvermeidbar sind, kann man so nur Textilfasern oder Bauteile für einfache technische Produkte gewinnen, allerdings spart man ca. 65 % des Energieaufwands im Vergleich zur Neuproduktion.
Über den zweiten Weg erhält man einen Polyester, der dem Neumaterial absolut entspricht, sodass das Material unbegrenzt einsetzbar ist.
Die Esterspaltung ist prinzipiell folgendermaßen möglich:
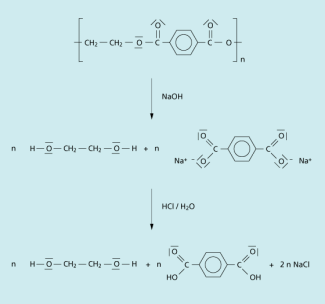
Alkalische Hydrolyse: Hierbei wird der Polyester durch starke Basen gespalten und anschließend die reine Terephthalsäure durch Ansäuern gewonnen. Ethandiol wird durch Destillation abgetrennt.
-
Alkalische Hydrolyse von PET
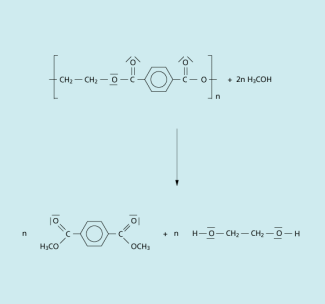
Methanolyse: Diese stellt eine Umkehrung der oben beschriebenen traditionellen Synthesereaktion dar, indem man bei höherem Druck Methanol auf den Polyester einwirken lässt und so in der Esterbindung das Ethandiol durch Methanol ersetzt. Auch bei Normaldruck ist diese Umesterung möglich, verläuft aber langsamer.
-
Methanolyse von PET
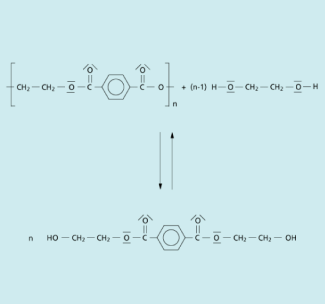
Katalytische Esterspaltung: Alternativ kann man den Polyester auch mit Ethandiol in Gegenwart von Zinkacetat als Katalysator erhitzen, wobei ebenfalls die Esterbindung gespalten wird und das Monomer Bishydroxyethylterephthalat entsteht.
In allen drei Fällen gelangt man zu einem völlig geschlossenen Stoffkreislauf.
-
Katalytische Esterspaltung