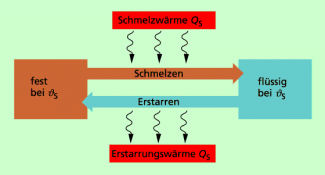
Schmelzen und Erstarren
Als Schmelzen bezeichnet man den Übergang vom festen in den flüssigen Aggregatzustand, als Erstarren den umgekehrten Übergang vom flüssigen in den festen Aggregatzustand. Dabei gilt:
- Schmelztemperatur und Erstarrungstemperatur sind gleich groß. Sie hängen vom jeweiligen Stoff und vom Druck ab.
- Schmelzwärme und Erstarrungswärme sind für einen bestimmten Stoff ebenfalls gleich groß.
Als Schmelzen bezeichnet man den Übergang vom festen in den flüssigen Aggregatzustand, als Erstarren den umgekehrten Übergang vom flüssigen in den festen Aggregatzustand.
Dabei gilt:
- Wird einem festen Körper Wärme zugeführt, dann geht er bei der Schmelztemperatur in den flüssigen Aggregatzustand über. Die zum Schmelzen erforderliche Wärme wird als Schmelzwärme bezeichnet.
- Wird einer Flüssigkeit Wärme entzogen, dann geht sie bei der Erstarrungstemperatur in den festen Aggregatzustand über. Die beim Erstarren frei werdende Wärme wird als Erstarrungswärme bezeichnet.
- Während des Schmelzens und des Erstarrens bleibt die Temperatur eines Körpers gleich groß.
- Beim Schmelzen vergrößert sich das Volumen eines Körpers, bei Erstarren verringert es sich. Wasser ist eine Ausnahme. Bei Wasser wird im Unterschied zu anderen Stoffen das Volumen beim Erstarren (Gefrieren) größer.
Die Zusammenhänge beim Schmelzen und Erstarren sind in Bild 2 dargestellt. Dabei gilt:
- Schmelztemperatur und Erstarrungstemperatur sind gleich groß. Sie hängen vom jeweiligen Stoff und vom Druck ab.
- Schmelzwärme und Erstarrungswärme sind für einen bestimmten Stoff ebenfalls gleich groß.
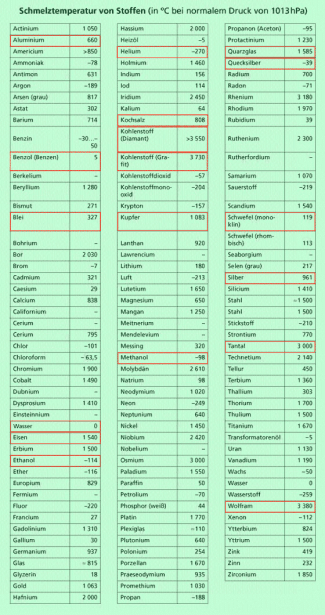
Schmelz- und Erstarrungstemperaturen
Die Schmelz- bzw. Erstarrungstemperaturen können sehr unterschiedlich sein. Meist werden diese Temperaturen auf den normalen Luftdruck von 1 013 hPa bezogen. Dabei ist zu beachten: Es gibt auch Stoffe für die man keine genaue Schmelztemperatur, sondern nur einen Temperaturbereich angeben kann, in dem sie schmelzen. Es sind sogenannte amorphe Stoffe. Zu ihnen gehören z.B. Wachs und Glas.
Bei Wasser und teilweise auch bei anderen Stoffen spielt die Druckabhängigkeit der Schmelztemperatur eine Rolle.
Für Wasser gilt:
Je größer der Druck ist, desto niedriger ist die Schmelztemperatur von Eis.
Wird z.B. mit Schlittschuhkufen ein großer Druck auf Eis ausgeübt, so schmilzt das Eis an den betreffenden Stellen auch bei Temperaturen weit unter dem Gefrierpunkt von 0 °C. Man gleitet mit den Schlittschuhen auf einem sehr dünnen Wasserfilm.
Bei fast allen anderen Stoffen, die sich beim Erstarren zusammenziehen, gilt umgekehrt:
Je größer der Druck ist, desto höher ist die Schmelztemperatur.
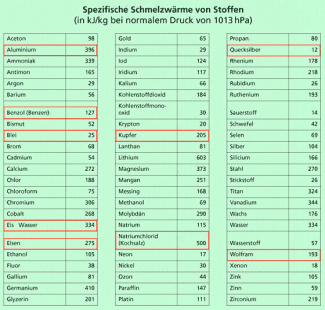
Spezifische Schmelzwärme und Schmelzwärme
Zum Schmelzen eines Stoffe ist Wärme erforderlich, die beim Erstarren wieder frei wird. Die für einen Stoff zum Schmelzen erforderliche Wärme wird durch die spezifische Schmelzwärme charakterisiert.
Die spezifische Schmelzwärme gibt an, wie viel Wärme erforderlich ist, um 1 kg eines Stoffes zu schmelzen.
| Formelzeichen: |
‚
| Einheit: | ein Kilojoule je Kilogramm |
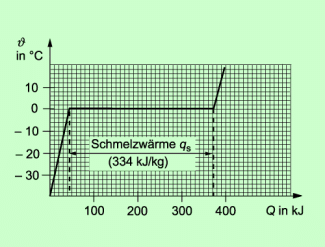
Für Eis beträgt diese spezifische Schmelzwärme 334 kJ/kg, Um 1 kg Eis zu schmelzen ist also eine Wärme von 334 kJ notwendig. Der Temperaturverlauf beim Schmelzen von Eis ist in Bild 4 dargestellt. Zur besseren Vergleichbarkeit wird in der Chemie die Schmelzwärme oft auf die Objektmenge 1 mol des Stoffes bezogen.
Deutung des Schmelzens und Erstarrens mit dem Teilchenmodell
Mit dem Teilchenmodell lassen sich die Vorgänge beim Schmelzen folgendermaßen deuten: Bei Zufuhr von Wärme erhöht sich die kinetische Energie der Teilchen des festen Körpers, die einen bestimmten Platz einnehmen, um den sie hin- und herschwingen. Die Teilchen bewegen sich heftiger, ihr mittlerer Abstand voneinander vergrößert sich. Schließlich können sie ihren festen Platz verlassen und sich beliebig gegeneinander bewegen. Der Stoff liegt dann als Flüssigkeit vor.
Beim Erstarren vollziehen sich die Vorgänge in umgekehrten Richtung: Bei Wärmeabgabe verringert sich die kinetische Energie der Teilchen. Ihr mittlerer Abstand voneinander wird kleiner. Schließlich werden sie aneinander gebunden und nehmen so einen festen Platz ein, um den sie hin- und herschwingen.