Silicone
Silicone sind siliciumorganische Kunststoffe, in denen die Siliciumatome noch organische Reste tragen. Sie ähneln in ihrer Struktur organisch modifiziertem Quarz, weisen eine ähnliche Beständigkeit auf und besitzen aber die Flexibilität von Kunststoffen.
Durch Variation der Synthesebedingungen kann die Struktur und damit die Eigenschaften der Silicone gezielt beeinflusst werden, sodass das Anwendungsspektrum nahezu unbegrenzt ist.
Silicone werden auch als Polysiloxane bezeichnet. Dabei steht „sil“ für Silicium, „ox“ für Sauerstoff und „an“ für die gesättigte Struktur der Verbindung.
Die Anwendung von Siliciumverbindungen blieb lange Zeit auf die oxidischen Verbindungen Siliciumdioxid bzw. Silicate beschränkt. Diese bilden die Grundlage der Glasherstellung, werden aber auch als keramische Werkstoffen oder Baustoffe verarbeitet.
Durch die Entdeckung der Methylchlorsilane während des 2. Weltkrieges wurde jedoch der Ausgangsstoff für die neue Werkstoffklasse der Silicone zugänglich. Die Herstellung der Silicone erfolgt in zwei Schritten:
- der Synthese der Organochlorsilane
- der Hydrolyse bzw. Methanolyse der Organochlorsilane mit anschließender Polykondensation
Die technisch wichtigsten Organochlorsilane sind die Methylchlorsilane. Zur Synthese wird ein fein vermahlenes Silicium/Kupfergemisch mit gasförmigem Chlormethan bei ca. 280 °C umgesetzt. Unter katalytischer Wirkung von Kupfer entsteht ein Gemisch von Silanen.![]()
Maßgeblich für die Wirtschaftlichkeit der Synthese ist eine möglichst hohe Ausbeute des bifunktionellen Dimethyldichlorsilans, da es Ausgangsstoff für alle Siliconöle, -emulsionen und -kautschuke ist. Aufgrund der geringen Siedepunktsunterschiede der Silane, erfordert ihre Trennung einen hohen destillativen Aufwand. Durch Einsatz anderer Chloralkane anstelle von Chlormethan können viele verschiedene Organochlorsilane erhalten werden.
Im zweiten Schritt werden zunächst die Organochlorsilane mit Wasser oder Methanol umgesetzt. Bei der Hydrolyse von 1 kg Dimethyldichlorsilan entstehen 350 Liter HCl, daher ist beim Umgang größte Vorsicht geboten. Die entstehenden Silanole reagieren anschließend in einer Polykondensation zu den Polysiloxanen bzw. Siliconen.![]()
Setzt man anstelle von Wasser Methanol zur Spaltung der Si-Cl-Bindungen ein, dann entsteht bei der Methanolyse wieder Chlormethan. Dieses Nebenprodukt kann wieder zu Chlormethylsilan umgesetzt und so dem Kreislauf zugeführt werden.![]()
Struktur und Eigenschaften
Silicone sind siliciumorganische Makromoleküle, in denen an die Siliciumatome unterschiedliche organische Reste gebunden sind. Die hohe Beständigkeit ergibt sich aus der Stabilität der Si-O- und der Si-C-Bindung sowie aus den hydrophoben organischen Resten. Von besonderer Wichtigkeit ist die Vernetzung der Siloxane für die Produkteigenschaften des Polymers. Diese kann durch die Zahl der Chloratome im Silanmolekül als Ausgangsstoff gezielt beeinflusst werden. Je nach Anzahl der Chloratome entstehen bei der Hydrolyse bzw. Methanolyse mono-, di-, tri- oder gar tetrafunktionelle Siloxane mit Si – O-Bindungen, die unterschiedliche Vernetzungsmöglichkeiten der Siloxaneinheiten aufweisen:![]()
Siliconöle sind lineare Polysiloxane , deren Kettenlänge die Viskosität bestimmt. Der Abbruch des Kettenwachstums erfolgt in der Regel durch Zugabe von monofunktionellem Trimethylchlorsilan. Vernetzte Siliconharze entstehen aus trifunktionellem Methyltrichlorsilan. Siliconkautschuke erhält man durch Vulkanisation linearer Silicone, d. h. durch Vernetzung mit geeigneten Reaktionspartnern.
Zur Modifizierung der Eigenschaften werden Füllstoffe wie sehr feinkörniges Siliciumdioxid und andere Zusatzstoffe eingearbeitet.
Von der gesamten Siliconproduktion (weltweit mehr als 2 Mio. t) sind etwa 46 % Siliconöle, 26 % Silicondichtstoffe, 26 % sonstige Silicon-Elastomere und etwa 6 % Siliconharze.
Silicone weisen eine für Kunststoffe hohe Thermostabilität bis ca. 250 °C und tiefe Glasübergangstemperaturen von -120 °C auf. Ursache ist auch hier die sehr feste Si – O-Bindung. Sie sind zudem chemikalienbeständig, unempfindlich gegen oxidierende Stoffe und Strahlung sowie hervorragende Isolatoren und stark hydrophob.
Silicone finden sich heute in allen Bereichen der Industrie und des täglichen Lebens. Unmittelbar begegnen sie uns wegen ihrer Wasser abweisenden und dauerelastischen Gebrauchseigenschaften als Dichtungsmittel im Sanitärbereich und als Imprägnierungsmittel für Textilien. Im Baubereich dienen sie zum Fassadenschutz, in der Elektroindustrie nutzt man sie für Kabelummantelungen oder den Bau von Freiluftisolatoren. In Haarshampoos stabilisieren Silicone den Schaum. Auch Sonnenschutzmittel enthalten Silicone.
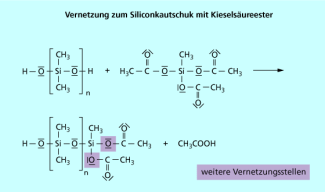
Selbstklebende Etiketten und Briefmarken befinden sich auf einer siliconbeschichteten Unterlage. Silicondichtmassen, die z. B. im Haushalt im Sanitärbereich eingesetzt werden, enthalten einen Vernetzer, der Essigsäure-Reste (Acetylgruppen) als reaktive Gruppen besitzt. Durch die Luftfeuchtigkeit wird daraus Essigsäure abgespalten (was am Geruch wahrnehmbar ist) und der Vernetzer wird somit aktiviert, da reaktive OH – Gruppen entstehen. Er kann dann die Silicone, die in der Dichtmasse vorliegen, unter Ausbildung größerer Ketten, vernetzen.
-
Es gibt unterschiedliche Methoden zur Bildung von Siliconkautschuk.