Sulfate
Die Salze der Schwefelsäure sind die Sulfate.
Sie kommen teilweise in der Natur vor oder werden z. B. durch Umsetzung von Schwefelsäure mit Metallhydroxiden bzw. andere industrielle Prozesse gezielt hergestellt.
Viele Sulfate finden Anwendung in der Technik, Medizin, Landwirtschaft und im Haushalt. Eines der wichtigsten Sulfate ist Calciumsulfat-Dihydrat, das als Gips seit über 2500 Jahren als Baustoff genutzt wird.
Die Salze der Schwefelsäure sind die Sulfate .
Verdünnte Schwefelsäure reagiert mit unedlen Metallen, Metalloxiden und Metallhydroxiden unter Bildung von Sulfaten und Wasserstoff bzw. Wasser.
Die Sulfate setzen sich aus Metall-Ionen und Sulfat-Ionen zusammen. Sulfat-Ionen besitzen folgende Valenzstrukturformel (LEWIS-Formel) bzw. räumliche Struktur:
![]()
Eigenschaften der Sulfate
Viele Sulfate sind in Wasser löslich (Sulfate der Alkalimetalle und Nebengruppenmetalle, Ammoniumsulfat). In wässriger Lösung liegen elektrisch positiv geladene Metall-Ionen und zweifach elektrisch negativ geladene Sulfat-Ionen vor. Schwer löslich in Wasser sind dagegen Erdalkalimetallsuflate wie Calciumsulfat und Schwermetallsulfate wie Bleisulfat oder Bariumsulfat .
In Wasser gelöste Sulfate rufen die bleibende (permanente) Wasserhärte hervor, da diese Salze auch nach dem Kochen des Wassers in gelöster Form vorliegen.
Nachweis von Sulfat-Ionen
Der Nachweis der Sulfat-Ionen erfolgt durch Versetzen einer schwach sauren Probelösung mit Bariumchloridlösung . Durch Fällung entsteht ein weißer Niederschlag aus Bariumsulfat.
Die Barium-Ionen verbinden sich mit den Sulfat-Ionen zu dem fast unlöslichen, weißen Bariumsulfat. Durch Ansäuern der Lösung mit verdünnter Salzsäure wird die Fällung des ebenfalls schwer löslichen Bariumcarbonats verhindert.
Wichtige Sulfate
Natriumsulfat , kommt in der Natur in den GUS-Staaten und in Kanada vor. Es wird bei der Herstellung von Waschmitteln und in der Glas- und Papierindustrie eingesetzt. Natriumsulfat kann Wasser aufnehmen und deshalb als Trockenmittel verwendet werden. Das Dekahydrat, , wird als Glaubersalz bezeichnet .
-
Zum Nachweis von Sulfat-Ionen nutzt man oft die Fällung von Bariumsulfat.

Heinz Mahler, Berlin
Calciumsulfat kommt Anhydrit in großen natürlichen Lagerstätten vor. Außerdem entsteht Calciumsulfat in großen Mengen bei der Rauchgasentschwefelung in Kraftwerken und als Abprodukt in Chemieanlagen.
In der Bauindustrie und beim Heimwerker wird , das sogenannte Hemihydrat, als Stuck- oder Putzgips eingesetzt. Beim Abbinden erfolgt Wasseraufnahme, wobei Gips, , entsteht. Das Abbinden erfolgt unter geringer Volumenzunahme, so dass feinste Reliefe wiedergegeben werden können.
Große Mengen Gips werden in der Bauindustrie (z. B. Gipskarton) und als Abbindeverzögerer in der Zementindustrie eingesetzt. Mit Gips wurde schon vor über 2500 Jahren gemauert.
Das Mineral Schwerspat besteht aus Bariumsulfat. Bariumsulfat ist in Wasser kaum löslich. Hauptverbraucher ist die Erdölindustrie, wo Bohrschlämme aus einer Bariumsulfat-Suspension bestehen. Außerdem erfolgt der Einsatz als Füllstoff in der Bau- und Papierindustrie, sowie als farbgebende Komponente in weißer Malerfarbe.
-
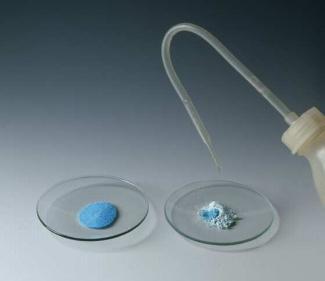
Wasserfreies Kupfersulfat färbt sich durch Wasseraufnahme blau.
Heinz Mahler, Berlin
Kupfersulfat ist farblos und reagiert mit Wasser zum Pentahydrat, , das blau gefärbt ist. Es kann deshalb zum Nachweis von Wasser, z. B. in organischen Lösemitteln, genutzt werden.
Kupfersulfat wird zur Herstellung von Farbpigmenten und Saatgutbeizen eingesetzt. Da Spuren von Kupfer niedere Organismen abtöten, hilft zum Frischhalten von Wasser in der Blumenvase die Zugabe einer Kupfermünze.
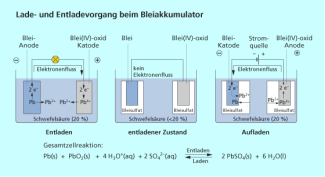
Das weiße Bleisulfat ist ebenfalls schwer löslich und bildet sich beim Entladevorgang im Bleiakkumulator:
Wird dem System von außen elektrische Energie zugeführt und der Akkumulator wieder aufgeladen, so kehrt sich der chemische Vorgang um, und es bilden sich Blei und Blei(IV)-oxid.
Ammoniumsulfat ist ein wichtiger Stickstoffdünger und wird zur Herstellung von Flammschutzmitteln eingesetzt. Kaliumsulfat dient zur Herstellung von Mischdüngern und Feuerlöschmitteln.
Als Mineral Kieserit, , kommt Magnesiumsulfat in der Natur vor. Das Heptahydrat, , wird als Bittersalz bezeichnet und diente früher als Abführmittel. Der Einsatz von Magnesiumsulfat erfolgt bei der Produktion von Mischdüngern und bei der Wasseraufbereitung.
Eine besonder Gruppe der Sulfate sind die Alaune , die verschiedene Kationen enthalten. Es handelt sich dabei um sogenannte Doppelsalze, die aus einem Sulfat eines einwertigen und eines dreiwertigen Metalls gebildet werden, z. B. Kalium-Aluminium-Alaun, .
Wegen der blutstillenden und fäulnishemmenden Wirkung wurden Alaune früher zur Mumifizierung genutzt. Auch zur Lederverarbeitung nutzten unsere Vorfahren Alaune.
-
Bleisulfat wird beim Entladen des Bleiakkumulators gebildet.