Sulfide
Sulfide sind die Salze der Schwefelwasserstoffsäure. Der Nachweis der zweifach negativ geladenen Sulfid-Ionen kann mit Schwermetall-Ionen, z. B. Blei(II)-Ionen (in Blei(II)-acetat), erfolgen. Es bildet sich bei dieser Fällungsreaktion ein schwarz gefärbter Niederschlag von Bleisulfid.
Bei den Sulfiden handelt es sich um feste, kristalline Stoffe, die in der Natur als sulfidische Erze vorkommen.
Sulfide sind die Salze der Schwefelwasserstoffsäure .
Schwefelwasserstoffsäure entsteht, wenn man gasförmiges Schwefelwasserstoff in Wasser löst. Ein Teil des gelösten Schwefelwasserstoffs protolysiert in Wasser und bildet eine schwach saure Lösung, die Schwefelwasserstoffsäure.
Das Säurerest-Ion heißt Sulfid-Ion . Die bezeichnet man als Hydrogensulfid-Ionen. Während die Alkalimetallsulfide in Wasser leicht löslich sind, ist die Löslichkeit von Schwermetallsulfiden (PbS, CuS, HgS) in Wasser sehr gering. Darauf beruhen auch viele Nachweisreaktionen von Sulfid-Ionen.
Nachweis des Sulfid-Ions
Der Nachweis der zweifach negativ geladenen Sulfid-Ionen kann mit Schwermetall-Ionen, z.B. Blei(II)-Ionen (in Blei(II)-acetat), erfolgen. Der Nachweis wird häufig mit Bleiacetat-Papier durchgeführt.
Es bildet sich bei dieser Fällungsreaktion ein schwarz gefärbter Niederschlag von Bleisulfid. Liegen Sulfid-Ionen nur in geringer Konzentration vor, erscheint die Fällung als braunschwarze Trübung.
Sulfid-Ionen können auch mit der sogenannten Hepar-Probe nachgewiesen werden. Eine Sulfid-Ionen enthaltende Lösung gibt auf einem Silberblech einen leberfarbenen (griech.: epar = Leber) Fleck des sehr schwer löslichen braunschwarzen Silbersulfids.
Vorkommen und Verwendung von Sulfiden
Bei den Sulfiden handelt es sich um feste, kristalline Stoffe, die chemisch gesehen Verbindungen von Schwefel mit Metallen darstellen.
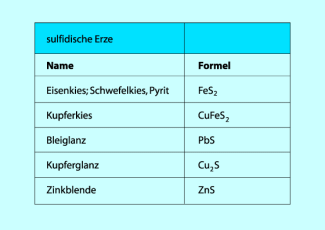
Sie kommen in der Natur als sulfidische Erze (Kiese, Blenden, Glanze) vor. Ein wichtiges dieser Erze ist Eisendisulfid , auch Pyrit oder Schwefelkies genannt. Durch Rösten erhält man daraus Schwefeldioxid und Eisenoxid.
Beim Erhitzen unter Luftzufuhr (Rösten) von Pyrit entstehen Eisen(III)-oxid und Schwefel(IV)-oxid. Allerdings nimmt die Bedeutung der Sulfide als Rohstoff für die Herstellung von Schwefeldioxid und daraus Schwefelsäure immer weiter ab.
Andere Sulfide, z. B. Quecksilbersulfid (Zinnoberrot), Bleisulfid (Bleiglanz), Cadmiumsulfid (Cadmiumgelb), Zinksulfid (Zinkblende), Antimonsulfid (Grauspießglanz) oder Arsensulfid (Auripigment), finden teilweise Verwendung als Künstlerfarben oder Schminken, hauptsächlich jedoch zur Gewinnung der entsprechenden Metalle.
-
Einige wichtige sulfidische Erze
Bildung von Sulfiden
Sulfide sind Salze der Schwefelwasserstoffsäure () und bilden sich durch Reaktionen dieser Säure. Sulfide entstehen jedoch auch durch Reaktionen von Schwefel oder schwefelhaltigen Verbindungen mit Metallen. Das schwarze Anlaufen von Silberschmuck oder silbernen Gegenständen beruht auf der oberflächlichen Bildung von Silbersulfid durch Spuren von Schwefelwasserstoff in der Luft.
Ag + H2S + 0,5 O2 → Ag2S + H2O
Analog werden silberne Löffel durch Speisen, die schwefelreiches Eiweiß enthalten (z. B. Eier) schwarz verfärbt.
Im Labor lassen sich eine Reihe von Sulfiden durch exotherme Reaktionen zwischen Metallen und Schwefel herstellen:
-
Silber (Silberlöffel) und Schwefel (aus Eiweißen) reagieren zu schwarzem Silbersulfid.

Heinz Mahler, Berlin

