Summen- und Strukturformeln
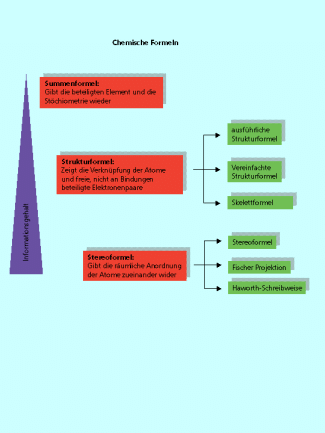
Es gibt unterschiedliche Möglichkeiten, organische Moleküle mit Formeln zu beschreiben. Die Summenformel gibt nur die stöchiometrische Zusammensetzung wieder. Struktur- und Stereoformeln zeigen, wie die einzelnen Atome im Molekül miteinander verbunden sind. Fischer-Projektion, Haworth-Schreibweise und Skelettformeln sind spezielle Formen organische Moleküle darzustellen.
Chemische Formeln
Für den Chemiker ist es wichtig, Verbindungen bzw. Teilchen in verkürzter Form oder ihre räumliche Anordnung zu beschreiben. Je nachdem welche Informationen zur Teilchenstruktur benötigt wurden, entwickelten sich im Laufe der Zeit unterschiedliche Arten von chemischen Formeln. Mit den unterschiedlichen Formel lassen sich entweder nur die stöchiometrische Zusammensetzung oder auch die komplette räumliche Struktur eines Moleküls modellhaft darstellen. In der Reihenfolge Summenformel → Strukturformel → Stereoformel wächst der Informationsgehalt aber auch der Schwierigkeitsgrad der Darstellung an.
-
Unterschiedliche Arten chemischer Formeln haben unterschiedlichen Informationsgehalt.
Summenformeln
Die Summenformel einer organischen Verbindung gibt die Zusammensetzung des Moleküls aus den einzelnen Atomen wieder. Es ist eine Aneinanderreihung von Symbolen der am Aufbau dieser Verbindung beteiligten Elemente. Ist die Anzahl einzelner Atome größer als eins, wird sie durch tief gestellte Zahlen (Indizes) am entsprechenden Symbol gekennzeichnet. Die Summenformel ist die einfachste Formel, die die stöchiometrische Zusammensetzung von Molekülen zum Ausdruck bringt.
Die Summenformel besagt, dass dieses Molekül aus drei Kohlenstoff-, sechs Wasserstoff- und drei Sauerstoffatomen aufgebaut ist. Die Summenformel sagt nichts über die Art der Verknüpfung der einzelnen Atome aus. Man kann die relative Molekülmasse und die prozentualen Anteile der Elemente aus der Summenformel berechnen. Als Synonyme für die Summenformel findet man mitunter die Begriffe Bruttoformel oder empirische Formel.
-
Die Summenformel verwendet man hauptsächlich für chemische Reaktionsgleichungen und stöchiometrische Berechnungen.

Strukturformeln
Wesentlich aussagefähiger ist die ausführliche Strukturformel, auch Konstitutionsformel oder Valenzstrich-Formel. Sie zeigt die Verknüpfung der einzelnen Atome im Molekül. Die durch gemeinsame Elektronenpaare verknüpften Atome werden mit sogenannten Valenzstrichen verbunden. Doppelbindungen werden durch zwei, Dreifachbindungen durch drei Valenzstriche dargestellt. Die freien, also nicht an einer Bindung beteiligten Elektronenpaare werden als „Querstriche“ gezeichnet.
Da die Struktur von funktionellen Gruppen in allen Verbindungen gleich ist, werden diese in vereinfachten Strukturformeln
verkürzt dargestellt. Das gilt für die Nitro-, die Amino-, die Aldehyd- und die Carboxy-Gruppe. Die Kohlenstoffatome und ihre Bindungen zu Wasserstoffatomen werden zu -, - bzw. CH-Gruppen zusammengefasst. Auch gesamte Strukturelemente wie ein Ether-Rest können verkürzt dargestellt werden. Ein typisches Beispiel ist die Methoxy- bzw. die Ethoxy-Gruppe (- bzw. -). In der vereinfachten Strukturformel verzichtet man auch auf die Darstellung freier Elektronenpaare.
Noch stärker vereinfacht sind die speziell in der organischen Chemie gebräuchlichen Skelettformeln. Hier stellt man nur die Zick-Zack-Struktur des Kohlenstoffskeletts und die funktionellen Gruppen im Molekül dar.
-
Die ausführliche Strukturformel zeigt funktionelle Gruppen und die Bindungsverhältnisse im Molekül. Ähnliche Informationen liefern die beiden vereinfachten Darstellungen.

Stereoformeln
Mit Stereoformeln verdeutlichen organische Chemiker die räumliche Anordnung der Substituenten, vor allem an den unterschiedlich hybridisierten Kohlenstoffatomen. Die klassische Stereoformel arbeitet mit Keilen und gestrichelten Linien für die Einfachbindungen. Ein Atom mit einem Keil kommt immer aus der Papierebene heraus. Eine gestrichelte Bindung geht immer in die Papierebene hinein. Auf diese Art kann z. B. die tetraedrische Koordination eines -Kohlenstoffatoms dargestellt werden (Bild 4).
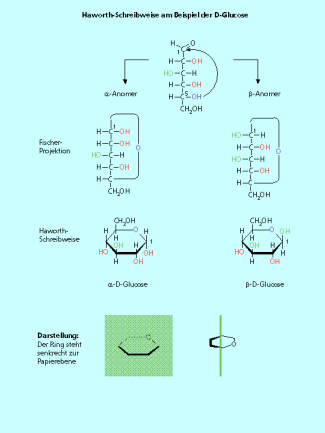
Eine der am häufigsten verwendeten Vereinfachungen der klassischen Stereoformel ist die Fischer-Projektion. Es handelt sich dabei um die „Einebnung der räumlichen Struktur“. Durch das Regelwerk dieser Darstellung ist auch in der zweidimensionalen Abbildung die räumliche Anordnung der Atome eindeutig erkennbar. Sie wird vor allem für Zucker und Aminosäuren genutzt, von denen mehrere Spiegelbildisomere existieren. Mithilfe der Fischer-Projektion kann die Zuordnung einer Verbindung in die D- oder L-Reihe vorgenommen werden.
-
Die Stereoformel verdeutlicht die räumliche Anordnung der Atomgruppen eines Moleküls. Die Fischer-Projektion ist eine Vereinfachung zur zweidimensionalen Darstellung der Raumstruktur.

Die Haworth-Schreibweise wird für Zucker in der Ringform verwendet. Dabei liegt das Ringsystem senkrecht zur Papierebene. Die keilförmigen Bindungen und die dicker gezeichnete Bindung kommen also auf den Betrachter zu. Die Substituenten stehen ober- und unterhalb dieses Rings.
Pyranosen:
Das Sauerstoffatom steht in der hinteren rechten Ecke. Ausgehend von der Fischer-Projektion zeigen die hier nach rechts stehenden Hydroxy-Gruppen nach oben, die nach links stehenden Hydroxy-Gruppen nach unten.
-
von der Fischer-Projektion zur Haworth-Schreibweise am Beispiel der Glucose
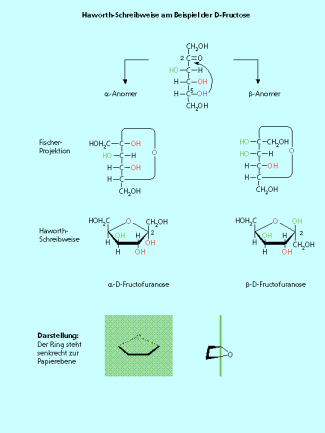
Furanosen:
Das Sauerstoffatom steht an der Spitze des Fünfrings und liegt am weitesten in der Papierebene. Analog den Pyranosen stehen die OH-Gruppen oberhalb und unterhalb dieses Rings. Die nach oben stehenden Hydroxy-Gruppen zeigen in der Fischer-Projektion nach rechts.
-
die Haworth-Schreibweise am Beispiel der D-Fructose
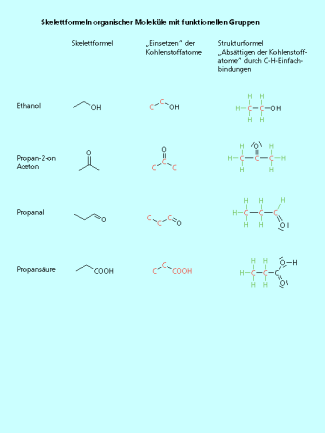
Skelettformeln
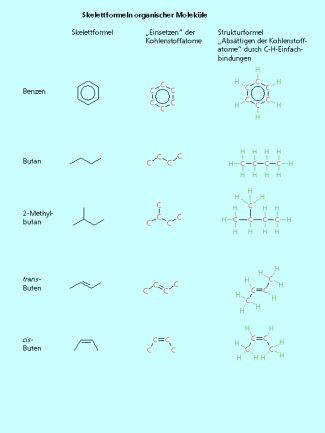
Skelettformeln werden sehr häufig für die Darstellung der Struktur organischer Moleküle benutzt. Bei diesen stark vereinfachten Strukturdarstellungen werden nur die Kohlenstoffkette und die Bindungen zu funktionellen Gruppen gezeichnet. Alle Wasserstoffatome, die an ein Kohlenstoffatom gebunden sind, werden einschließlich der Bindung weggelassen. Dadurch sind die Strukturformeln sehr übersichtlich.
Vom Benzenring ist die Verwendung einer Skelettformel jedem bekannt. Jede Ecke ist mit einem Kohlenstoffatom besetzt. Jedes Kohlenstoffatom ist -hybridisiert und durch das ![]() -Elektronensextett hat jedes Kohlenstoffatom bereits drei Bindungen. Es bleibt nur eine Bindung zu einem Wasserstoffatom, das nicht dargestellt ist, übrig. Nach dem gleichen Schema kann man alle organischen Moleküle in einer Skelettformel darstellen. Im Butan sind vier Kohlenstoffatome über Einfachbindungen unverzweigt miteinander verknüpft. Bei der Darstellung in der Skelettformel muss man beachten, dass neben den beiden „Knicken“ auch der Anfang und das Ende der Kette mit einem Kohlenstoffatom zu besetzen sind. Auch Moleküle mit Doppelbindungen können als Skelettformel dargestellt werden. Selbst die Stereochemie an der C=C-Doppelbindung ist auch in der Skelettformel eindeutig darstellbar.
-Elektronensextett hat jedes Kohlenstoffatom bereits drei Bindungen. Es bleibt nur eine Bindung zu einem Wasserstoffatom, das nicht dargestellt ist, übrig. Nach dem gleichen Schema kann man alle organischen Moleküle in einer Skelettformel darstellen. Im Butan sind vier Kohlenstoffatome über Einfachbindungen unverzweigt miteinander verknüpft. Bei der Darstellung in der Skelettformel muss man beachten, dass neben den beiden „Knicken“ auch der Anfang und das Ende der Kette mit einem Kohlenstoffatom zu besetzen sind. Auch Moleküle mit Doppelbindungen können als Skelettformel dargestellt werden. Selbst die Stereochemie an der C=C-Doppelbindung ist auch in der Skelettformel eindeutig darstellbar.
-
Die Skelettformel ist eine stark vereinfachte Schreibweise der ausführlichen Strukturformel. Bis auf die freien Elektronenpaare lassen sich mit ein bisschen Übung die gleichen Information entnehmen.
Bei Molekülen mit funktionellen Gruppen wird diese in der verkürzten Form dargestellt. Die Ausnahme ist die Aldehyd-Gruppe; hier wird nur die Doppelbindung zum Sauerstoffatom gezeichnet.
Weitere Modelle zur Darstellung von Molekülstrukturen
Neben den Summen- und Strukturformeln existieren noch weitere Modelle zur Darstellung der räumlichen Anordnung von Atomen und Atomgruppen im Molekül. Gebräuchlich sind hauptsächlich das Kugel-Stab-Modell und das Kalottenmodell, die jedoch einiges zeichnerisches Geschick oder ein entsprechendes Computerprogramm erfordern.
Diesen Modellen können Informationen zur Größe der Atome und zur Bindungslänge (Atomabstand) sowie zum Bindungswinkel entnommen werden.
-
Skelettformeln von organischen Molekülen mit funktionellen Gruppen