Verbindungen Chlor
Chlor ist als Element der VII. Hauptgruppe ein sehr reaktionsfreudiges Gas und bildet eine Vielzahl von organischen und anorganischen Verbindungen.
Die wichtigsten anorganischen Verbindungen sind Chlorwasserstoff, Chlorwasserstoffsäure und die natürlich vorkommenden Metallchloride. Diese dienen als Rohstoffe zur Herstellung vieler Chemikalien und Produkte, z. B. Chlor, Natronlauge, Soda, PVC u. a. m. Kaliumchlorid wird hauptsächlich zu Kalidüngemitteln verarbeitet.
Mit dem reaktiven Chlor als Ausgangsstoff kann eine Vielzahl organischer Chlorverbindungen hergestellt werden, die früher eine breite Anwendung fanden und z. T. wie der Kunststoff Polyvinylchlorid (PVC) auch heute noch genutzt werden. Die Verwendung vieler chlorhaltiger Produkte ist jedoch ökologisch bedenklich. So können bei der Enstorgung Umweltgifte wie Dioxine entstehen. Andere Chlorverbindungen, die Fluorchlorkohlenwasserstoffe (FCKW) sind verantwortlich für die Zerstörung der Ozonschicht in der Stratosphäre.
Chlor ist ein Element der VII. Hauptgruppe und hat seinen Namen durch die Farbe des Chlorgases vom griechischen „chloros“ für grün.
Das Chloratom besitzt 17 Protonen und 18 oder 20 Neutronen im Atomkern sowie 17 Elektronen in der Atomhülle. Auf der ersten Elektronenschale befinden sich zwei, auf der zweiten Elektronenschale acht und auf der dritten Elektronenschale sieben Elektronen, sodass Chlor über sieben Außenelektronen verfügt.
Um eine stabile Elektronenanordnung, die Achterschale des Argons zu erreichen, muss das Chloratom ein Elektron aufnehmen. Mit elektropositiven Partnern, z. B. Metallen, bildet Chlor daher ionische Verbindungen, Salze wie NaCl, mit einfach negativ geladenen Chlorid-Ionen. Mit den elektronegativeren Nichtmetallen wie Kohlenstoff geht Chlor aber auch polare Atombindungen ein, um das Elektronenoktett zu erreichen.
Das Element Chlor kommt immer als zweiatomiges Molekül vor. Die beiden Chloratome sind durch ein gemeinsames Elektronenpaar miteinander verbunden. Diese Atombindung ist unpolar, da die Elektronegativität der beiden Chloratome gleich ist. Jedes Chloratom besitzt noch sechs nichtbindende Elektronen (drei Paare).
Chlor ist ein stechend riechendes, grün-gelbes, sehr giftiges Gas. Es kann unter Druck leicht verflüssigt werden. In Wasser ist Chlor nur wenig löslich, die ca. 0,5 %ige Lösung wird als Chlorwasser bezeichnet. Chlor ist schwerer als Luft (ca. 2,5-fach). Das Gas kann Bakterien und Algen vernichten und wird in geringen Mengen dem Wasser in Schwimmbädern zur Desinfektion zugesetzt.
Reaktionen des Chlors
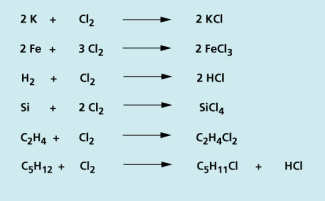
Chlor gehört neben Fluor zu den reaktionsfreudigsten Elementen. Aufgrund seiner starken Neigung, ein Elektron zur Vervollständigung des Elektronenoktetts aufzunehmen, ist es ein starkes Oxidationsmittel. Chlor reagiert schon bei Raumtemperatur mit vielen Elementen unter großer Wärmeentwicklung (exotherme Reaktionen). Mit Alkali-, Erdalkali- und anderen Metallen bildet es ionische Verbindungen, die Metallsalze.
Aber auch Nichtmetalle wie Wasserstoff und Phosphor, Halbmetalle wie Bor und Silicium oder organische Kohlenwasserstoffe wie Ethen und Pentan reagieren mit Chlor zu Molekülverbindungen.
-
Reaktionen des Chlors
Da Chlor ein sehr reaktives Element ist, kommt es in der Natur fast ausschließlich in Verbindungen vor. Riesige Salzlagerstätten enthalten hauptsächlich die Minerale Steinsalz (NaCl), Sylvin (KCl) oder Sylvinit. Schier unermesslich sind die in den Weltmeeren gelösten Mengen an Chloriden, wenn man bedenkt, dass ein Massenanteil von 3,4 % des Salzwassers größtenteils Chloridsalze sind. Chloride werden beim Eindampfen von Meerwasser gewonnen (Bilder 5).
Chlor wird durch Elektrolyse aus wässrigen Kochsalzlösungen gewonnen. Hierbei sind vor allem drei Verfahren im Einsatz, das Amalgamverfahren, das Diaphragmaverfahren und das Membranverfahren.
Chlor ist ein wichtiger Grundstoff der chemischen Industrie. Es ist Ausgangsstoff für Bleichmittel, die Herstellung des Kunststoffs Polyvinylchlorid (PVC), von Siliconen und Waschmitteln. Es dient außerdem der Herstellung organischer Produkte, z. B. von Lösemitteln wie Chloroform, Schädlingsbekämpfungsmitteln (Pestizide) und Unkrautvernichtungsmitteln (Herbizide).
-
prinzipieller Aufbau einer Entsalzungsanlage (Schema)
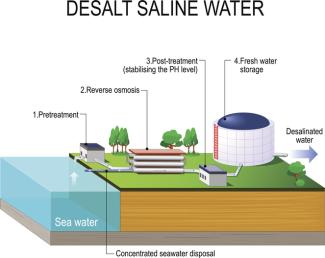
ttsz - iStock
Chlor-Verbindungen
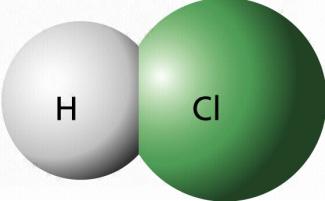
Wichtige anorganische Verbindungen des Chlors sind Chlorwasserstoff und Chloride. Chlorwasserstoff ist ein Molekül. Es besteht aus einem Atom Chlor und einem Atom Wasserstoff, die durch eine polare Atombindung verbunden sind.
Chlorwasserstoff ist farblos, gasförmig, stechend riechend, nicht brennbar und sehr gut wasserlöslich. Die wässrige Lösung reagiert sauer, da Chlorwasserstoff in einer Reaktion mit Protonenübergang ein Wasserstoff-Ion an das Wassermolekül abgibt. Es entstehen Oxonium-Ionen und Chlorid-Ionen, die gebildete Säure ist Chlorwasserstoffsäure bzw. Salzsäure.
-
Chlorwasserstoffmolekül
Der gasförmige Chlorwasserstoff ist reaktionsträger als seine wässrige Lösung, die Salzsäure. Salzsäure ist eine starke Säure, da das HCl-Molekül in wässriger Lösung vollständig in Wasserstoff-Ionen und Chlorid-Ionen dissoziiert. Salzsäure reagiert mit unedlen Metallen in einer Redoxreaktion unter Bildung von Wasserstoff und Metallchloriden. Sie löst eine Reihe von Metalloxiden und Metallcarbonaten und kann deshalb zur Metallreinigung (Beizen, 2) und zur Beseitigung von Kesselstein (3) verwendet werden.
Im Magen des Menschen kommt Salzsäure mit einem pH- Wert von 2 vor. Sie aktiviert das Eiweiß verdauende Enzym Pepsin und tötet Keime ab, die mit der Nahrung in den Magen gelangt sind. Der Magen selber wird vor dem Angriff der ätzenden Säure mit einer dicken Schleimschicht geschützt. Salzsäure und Chlorwasserstoff fallen zu fast 90 % als Nebenprodukt bei Chlorierungen in der organischen Chemie an und müssen deshalb nicht noch zusätzlich in größeren Mengen hergestellt werden. Übliche Handelsformen sind verdünnte Salzsäure (etwa 7 %ig), konzentrierte Salzsäure (etwa 30 %ig) und rauchende Salzsäure (etwa 37 %ig).Als starke anorganische Säure wird die Salzsäure in vielen Industriezweigen eingesetzt. Neben der Behandlung von Metallen dient sie als Ausgangsstoff für die Herstellung verschiedener Chlorverbindungen, der Gewinnung von Glucose bei der Holzverzuckerung, zur Neutralisation z. B. von alkalischen Abwässern und zur Säurebehandlung von Erdöl- und Erdgasquellen.
Chloride sind die Verbindungen der Chlorwasserstoffsäure (Salzsäure). Die Chloride der Metalle sind Ionenverbindungen. Das Gitter besteht aus positiv geladenen Metall- oder Ammonium-Ionen und negativ geladenen Chlorid-Ionen. Chloride bilden sich durch Redoxreaktion von Chlorwasserstoffsäure mit unedlen Metallen, mit Metalloxiden oder durch Neutralisationsreaktion mit Metallhydroxiden.
Reaktion von Chlorwasserstoffsäure mit Magnesium
Chloride sind meist in Wasser sehr gut löslich, und dissoziieren in positiv geladene Kationen und Chlorid-Anionen.
Wichtige ionische Chloride sind Natriumchlorid und Kaliumchlorid, die natürlich vorkommenden Chloride der Alkalimetalle. Natriumchlorid aus Salzlagerstätten wird als Steinsalz bezeichnet. Nur ein geringer Teil des gewonnenen Steinsalzes wird als Kochsalz für unsere Speisen und als Konservierungmittel für Fisch- und Fleischwaren verwendet. In der chemischen Industrie wird Natriumchlorid als Ausgangsstoff für viele Chemikalien und Produkte, z. B. Salzsäure, Natronlauge, Chlor, Soda, eingesetzt.
Kaliumchlorid und daraus hergestellte andere Kaliumsalze wie Kaliumsulfat sind wichtige mineralische Düngemittel, die Kalium-Ionen enthalten. Kalium ist ein Hauptnährstoff für die Pflanzen. Ebenso wie Natriumchlorid wird Kaliumchlorid als chemischer Rohstoff genutzt.
Die Halbmetalle und Nichtmetalle bilden mit dem elektronegativeren Chlor Molekülverbindungen mit polaren Atombindungen (BCl3, CCl4, SiCl4, PCl3). Diese Chloride reagieren mit Wasser unter Hydrolyse mit Bildung der entsprechenden Säuren.
BCl3 + 3 H2O –→ B(OH)3 + 3 HCl
Kohlenstofftetrachlorid wird aber nicht hydrolisiert, weil die großen Chloratome die Kohlenstoff-Chlor-Bindung vor dem Wasser abschirmen. Es ist somit kinetisch stabil, obwohl rein thermodynamisch betrachtet, eine Hydrolyse erfolgen sollte.
Chlor-Sauerstoff-Verbindungen sind sehr reaktive, wenig stabile Oxide. Sie haben ähnlich wie die Sauerstoffsäuren des Chlors und deren Salze nur eine geringe praktische Bedeutung.
Neben den anorganischen existiert eine riesige Anzahl von organischen Chlorverbindungen, z. B. Chlorkohlenwasserstoffe, Säurechloride, chlorierte aromatische Verbindungen wie Chlorbenzen. Dabei handelt es sich aber fast ausschließlich um vom Menschen hergestellte (anthropogene) Verbindungen. In der Natur existieren hingegen nur wenige organische Chlorverbindungen. Viele dieser anthropogenen Organochlorverbindungen besitzen für bestimmte Anwendungen (z. B. Technik, Medizin) günstige Eigenschaften, sodass sie in großem Umfang hergestellt und genutzt wurden. Organochlorverbindungen wurden früher wie Chloroform als Narkose- oder Tetrachlormethan als Lösemittel genutzt.
Organische Chlorverbindungen wie DDT wurden als Insektizide eingesetzt und die PCBs dienten unter anderem als Wärmeüberträgerflüssigkeiten und Weichmacher. Auch der aus Monochlorethen (Vinylchlorid) hergestellte Kunststoff Polyvinylchlorid (PVC) fand und findet noch heute breite Anwendung.
-
Salzsäure

Heinz Mahler, Berlin
Die Verwendung vieler chlorhaltiger Produkte ist jedoch ökologisch bedenklich. Zum einen wird bei der elektrolytischen Herstellung von Chlor sehr viel Energie verbraucht. Viel schwerer fällt jedoch ins Gewicht, dass viele chlorhaltige Produkte ein Umwelt und Gesundheit schädigendes Potenzial haben. Die Ursache ist darin zu suchen, dass sich wegen des Mangels an natürlichen organischen Chlorverbindungen im Laufe der Evolution nur sehr wenige Mikroorganismen auf den Abbau dieser Verbindungen spezialisiert haben.
Die Folge ist, dass diese nicht-natürlichen Verbindungen oft sehr lange in der Umwelt verbleiben, weil sie auch chemisch sehr stabil sind. Gelangen die Verbindungen dann in Nahrungsketten, kommt es zur Anreicherung der Verbindung im Organismus bei den Endgliedern der Kette (Bioakkumulation). Die relativ hohen Konzentrationen können dann oft chronische Schäden im Lebewesen hervorrufen.
Die bis vor kurzem als Kühlmittel genutzten Fluorchlorkohlenwasserstoffe (FCKW) sind beispielsweise verantwortlich für die Zerstörung der Ozonschicht in der Stratosphäre. Bei der Entsorgung organischer Chlorverbindungen und von Kunststoffabfällen aus PVC entstehen hochgiftige Dioxine und andere ebenfalls giftige Chlorverbindungen, die die Menschen belasten. Auch chlorhaltige Lösemittel schädigen die Gesundheit, sodass z. B. Chloroform schon seit langem nicht mehr als Narkosemittel eingesetzt wird. Aus diesem Grund versucht man, Chlorverbindungen durch andere, weniger Umwelt schädigende Produkte zu ersetzen.

