Waschmittel
Waschmittel sind nicht einfache Seifen, die zur Reinigung von Textilien dienen, sondern es sind komplexe Produkte, die aus einer ganzen Reihe von chemischen Substanzen bestehen.Der folgende Artikel nennt die wichtigsten Inhaltsstoffe heutiger Waschmittel und erklärt deren Funktionsweise.
Aufbau und Arten von Tensiden
Der wohl wichtigste Bestandteil eines Waschmittels sind die wasch- und grenzflächenaktiven Substanzen, die sogenannten Tenside. Sie bilden jedoch nur etwa 10 bis 15 Prozent (Massenanteil) des Waschmittels.
Der Bau der Tenside ähnelt dem Bau herkömmlicher Seifen. So bestehen sie sowohl aus einem polaren als auch einem unpolaren Ende. Wobei die unterschiedlichen Tensidarten durch den polaren Teil bestimmt werden.
Kationische Tenside enthalten in ihrem Molekül eine positiv geladene quartäre Ammoniumgruppe (Beispiel: Tetraalkylammoniumchlorid). Kationische Tenside sind jedoch nur selten in Waschmitteln enthalten. Sie sind in Weichspülern vorzufinden, da sie die Oberflächenbeschaffenheit der Fasern ändern. Sie machen die Wäsche weicher.
Im Gegensatz dazu enden anionische Tenside in ihren Molekülen mit einer negativ geladenen Gruppe, beispielsweise einer Sulfonat- oder Carboxylatgruppe (Beispiel: Alkylbenzolsulfonat).
In den letzten Jahren wurden verstärkt Olefinsulfonate, Fettalkoholsulfonate oder auch Fettalkohol-Polyglykolsulfate eingesetzt, da diese anionischen Tenside neben der Härteunempfindlichkeit auch eine gute Hautverträglichkeit sowie eine überaus gute Waschkraft vor allem bei niedrigen Temperaturen aufweisen.
Dabei unterscheidet man jedoch zwischen den Sulfaten und den Sulfonaten. Sulfate werden verstärkt für Woll- und Feinwaschmittel sowie als Shampoo, Schaumbadzusatz und Geschirrspülmittel eingesetzt, wogegen die Sulfonate hauptsächlich als Textilienwaschmittel eingesetzt werden.
Nichtionische Tenside (Beispiel: Fettalkoholpolyglykolether) besitzen einen polaren Teil, der im Gegensatz zu den ionischen Tensiden, nicht elektrisch geladen ist, sondern mehrere Ethergruppen enthält. Diese bewirken hier die Löslichkeit im polaren Lösungsmittel (z.B. Wasser).
Auf Grund der Unabhängigkeit der Waschwirkung vom pH-Wert, einer geringeren Schaumbildung sowie einer verbesserten Waschwirkung im Temperaturbereich von 30 bis 60°C gegenüber Alkylbenzolsulfonaten steigern die nichtionischen Tenside ihren Marktanteil. Jedoch verhindern der hohe Preis und die aufwändige Produktion dieser Tenside einen stärkeren Einsatz solcher waschaktiver Substanzen.
Wirkungsweise von Tensiden
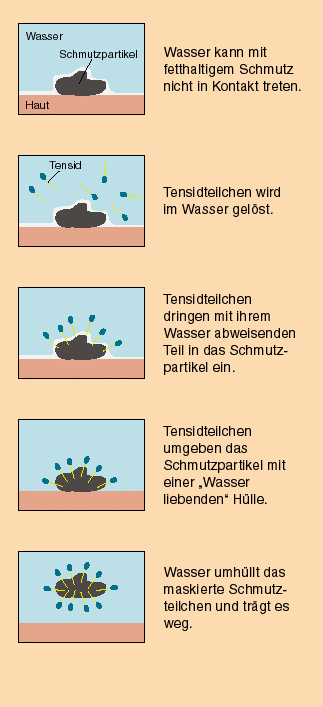
Da Tenside ähnlich aufgebaut sind wie Seifen, ist deren Wirkungsweise auch gleich. Die Tenside verringern die Grenzflächenspannung des Wassers.
Dadurch dringt das Wasser leichter in das Gewebe ein und die Fasern werden besser mit der Waschlösung benetzt. Die unpolaren (hydrophoben = wasserabweisenden) Enden der Tenside umschließen die Schmutzpartikel. Die Partikel werden von der Waschlauge aufgenommen (emulgiert bzw. suspendiert).
Dieser Vorgang wird durch zwei Faktoren begünstigt. Fasern mit polaren Gruppen binden vorwiegend Hydroxidionen über Wasserstoffbrücken.
Dadurch entsteht das alkalische Milieu beim Waschen, welches wiederum die Fasermoleküle negativ auflädt. Das fördert die Ablösung der negativ geladenen Schmutzteilchen.
Die Wärme und die Waschbewegungen bewirken weiterhin, dass der Schmutz in kleinere Partikel zerlegt wird, die besser von der Lauge aufgenommen werden können.
Wasserenthärter
Den größten Massenanteil am Waschmittel haben sogenannte Builder. Sie haben einen Anteil von etwa 30 bis 40 Prozent und dienen dazu, härtebildende Ionen in Lösung zu halten und dadurch Verkrustungen schwer löslicher Salze auf Faser und Maschine zu verhindern.
Die Builder (oder auch Komplexbildner genannt) sind wasserlösliche Salze (Beispiel: Pentanatriumtriphosphat), die mit den härtebildenden Ionen reagieren und diese in Lösung halten.
Da diese Phosphate aber zur Eutrophierung der Gewässer beitrugen, wurden sie weitgehend durch Zeolith A oder Polycarboxylate als moderne Wasserenthärter ersetzt.
Bleichmittel
Viele farbige Verschmutzungen werden meist nur von Bleichmitteln aus der Wäsche „entfernt“ (Beispiel: Natriumperborat).
Das heißt, die Flecken werden gebleicht oder oxidiert, wodurch sie nicht mehr sichtbar sind. Das Natriumperborat wird im Waschprozess zu Natriumdihydrogenborat und Wasserstoffperoxid umgesetzt. Wasserstoffperoxid ist in wässriger Lösung ein überaus gutes Bleichmittel, dessen Bleichwirkung jedoch erst ab einer Temperatur von 60 °C bemerkbar wird.
Zusatzstoffe
Neben oben genannten Inhaltsstoffen sind weitere Substanzen in Waschmitteln, die die Reinigungswirkung erhöhen.
So entfernen Enzyme wie Proteasen oder Amylasen eiweiß- und stärkehaltige Verschmutzungen (zum Beispiel Blut, Milch oder Kakao). Jedoch ist deren Waschwirkung auf den Temperaturbereich von 35 bis 60 °C begrenzt, da sonst die Enzyme durch eine höhere Temperatur zerstört werden.
Weißtöner sorgen dafür, dass weiße Wäsche richtig weiß aussieht. Diese Substanzen besitzen die Fähigkeit ultraviolettes Licht zu absorbieren und dafür bläuliches Licht auszusenden. Dadurch erscheint die weiße Wäsche für das menschliche Auge weiß. Diese, biologisch meist schwer abbaubaren, Substanzen werden deshalb auch als optische Aufheller bezeichnet.
Weitere, nicht jedoch so wichtige, Inhaltsstoffe von Waschmitteln sind Vergrauungsinhibitoren (tragen den Schmutz besser in Lösung), Schaumregulatoren (verhindern übermäßige Schaumbildung) sowie Korrosionsinhibitoren beziehungsweise Stellmittel (schützen Maschinenteile vor Korrosion).
-
Aufbau und Wirkungsweise eines Tensids
Suche nach passenden Schlagwörtern
- Tetraalkylammoniumchlorid
- Schaumregulatoren
- Grenzflächenspannung
- waschen
- Waschmittel
- Ethergruppen
- Olefinsulfonate
- Stellmittel
- Vergrauungsinhibitoren
- Bleichmittel
- Fettalkoholpolyglykolether
- Enzyme
- Tenside
- nichtionische Tenside
- Pentanatriumphosphat
- Amylasen
- anionische Tenside
- Ammoniumgruppe
- Proteasen
- Alkylbenzolsulfonat
- Sulfonat
- Fettalkoholsulfonate
- kationische Tenside
- Fettalkohol-Polyglykolsulfate
- Carboxylatgruppe

