Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen und verschiedene Arten von VAN-DER-WAALS-Wechselwirkungen fasst man unter dem Begriff zwischenmolekulare Wechselwirkungen zusammen. Insbesondere Wasserstoffbrückenbindungen spielen eine bedeutende Rolle in der Natur. So ist die für die Entwicklung des Lebens auf der Erde wichtige Anomalie des Wassers maßgeblich auf Wasserstoffbrücken zwischen den Molekülen zurückzuführen. Auch die Struktur von Proteinen und die sichere Speicherung der Erbinformation hängen von dieser besonderen Wechselwirkung zwischen Teilchen ab.
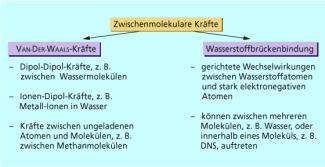
Die Eigenschaften aller Stoffe werden durch ihren chemischen Bau bestimmt. Dazu gehört in erster Linie die Struktur der Moleküle oder des Gitters, in dem Feststoffe kristallisieren. Bei Molekülverbindungen - also Verbindungen wie Wasser, Kohlenwasserstoffen und Alkoholen usw. - spielen darüber hinaus noch die zwischenmolekularen Wechselwirkungen eine wichtige Rolle. Diese unterteilt man in Wasserstoffbrückenbindungen undVAN-DER-WAALS-Kräfte.
-
Unterteilung der zwischenmolekularen Kräfte
Wasserstoffbrückenbindungen
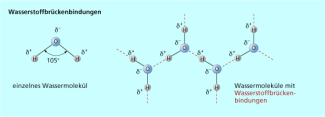
Wasserstoffbrückenbindungen entstehen zwischen Molekülen, in denen Wasserstoffatome an besonders stark elektronegative Atome (z. B. Fluor, Sauerstoff oder Stickstoff) gebunden sind.
Die Atombindung zwischen stark elektronegativen Atomen und Wasserstoffatomen ist in hohem Maße polarisiert, da das Fluor-, das Sauerstoff- und das Stickstoffatom bindende Elektronenpaare besonders stark anziehen. An den kovalent gebundenen Wasserstoffatomen herrscht dadurch Elektronenmangel, sodass diese partiell positiv geladen sind und mit den freien Elektronenpaaren von anderen elektronegativen Atomen in Wechselwirkung treten.
Die Wasserstoffbrückenbindungen sind zwar schwächer als normale Atombindungen, beeinflussen aber die Eigenschaften des Stoffes gravierend. So wäre Wasser mit einer molaren Masse von 18 g/mol trotz des Dipolcharakters des Wassermoleküls nicht flüssig, wenn nicht viele Wassermoleküle untereinander durch Wasserstoffbrücken verbunden wären. Dadurch wird der Phasenübergang von flüssigem Wasser zu gasförmigem Wasserdampf erschwert.
-
Wassermoleküle mit Wasserstoffbrückenbindungen
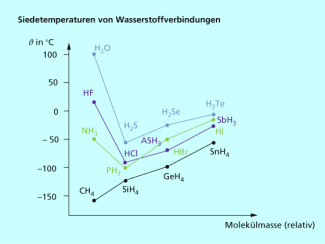
Die Bindungsenergie von Wasserstoffbrücken liegt zwischen 10 und 50 kJ/mol und ist damit geringer als bei „normalen“ Atombindungen. Trotzdem ist die Wechselwirkung stärker als andere zwischenmolekulare Kräfte und beeinflusst auch die Siedetemperaturen von anderen Element-Wasserstoff-Verbindungen entscheidend.
Auch Alkohole weisen deutlich höhere Siedepunkte als Alkane vergleichbarer molarer Masse auf. Ursache ist hier ebenfalls die Ausbildung von Wasserstoffbrücken zwischen den Alkoholmolekülen. Diese starke zwischenmolekulare Wechselwirkung führt dazu, dass die Alkoholmoleküle in der Flüssigkeit zurückgehalten werden und erst bei starker Energiezufuhr, also deutlich höheren Temperaturen in die Gasphase übergehen.
-
Aufgrund von Wasserstoffbrückenbindungen zwischen den Molekülen sind Ammoniak, Wasser und Fluorwasserstoff viel schwerer flüchtig als andere Element-Wasserstoff-Verbindungen in ihren homologen Reihen.
Nicht nur die Flüchtigkeit von flüssigen Stoffen auch die Struktur fester Stoffe wird durch Wasserstoffbrückenbindungen beeinflusst. Das bekannteste Beispiel ist auch hier das Wasser, das im gefrorenen Zustand verschiedene Strukturen ausbilden kann. Die häufigste Modifikation ist die von normalem Eis. Darin ist jedes Sauerstoffatom tetraedrisch von vier Wasserstoffatomen umgeben. Zwei Wasserstoffatome sind kovalent im Wassermolekül gebunden, zu den beiden anderen werden dagegen Wasserstoffbrückenbindungen mit etwas größerer Bindungslänge ausgebildet. Diese Anordnung führt zu einer weitmaschigen Gitterstruktur, sodass die Dichte des Eises geringer ist als die des flüssigen Wassers. Diese Eigenschaft gehört neben anderen zur Anomalie des Wassers , die in der Natur von großer Bedeutung ist. So beruht u. a. dass Zufrieren von Gewässern im Winter, die Verwitterung von Gesteinen und das milde Klima in den Regionen um den Golfstrom letztlich auch auf den Wasserstoffbrückenbindungen zwischen Wassermolekülen.
-
Struktur von normalem Eis
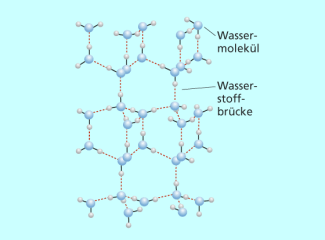
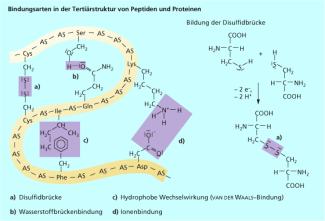
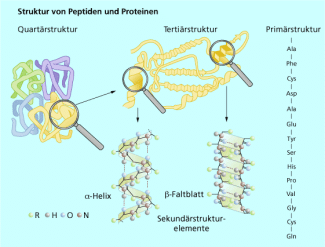
Diese beeinflussen auch die Struktur von Eiweißen und Nucleinsäuren. Bei der Sekundärstruktur von Eiweißen unterscheidet man zwischen der Helix und der Faltblatt-Struktur. Beide räumliche Anordnungen einzelner Abschnitte der Peptidketten werden durch Wasserstoffbrücken stabilisiert. Auch bei der Ausbildung der Tertiärstruktur der gesamten Peptidkette spielen Wasserstoffbrückenbindungen eine Rolle (Bild 9, siehe unten).
-
Die Sekundärstrukturelemente von Eiweißen werden durch Wasserstoffbrücken (rot gestrichelt) stabilisiert.
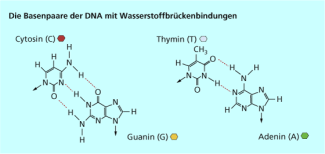
Selbst an der Weitergabe des genetischen Codes von Lebewesen sind Wasserstoffbrücken beteiligt. Die Desoxyribonucleinsäure (DNA) als Träger liegt in Form einer gewundenen Doppelhelix vor (Animation). Die beiden Stränge der Helix sind untereinander durch Wasserstoffbrücken verbunden. Die einzelnen Bausteine der DNA, die Nucleotide sind so strukturiert, dass nur bestimmte Kombinationen von Nucleotiden möglich sind. Dadurch dass nur Cytosin zu Guanin und Thymin zu Adenin passen, ist der genetische Code über die Reihenfolge dieser Basen in der Nucleotidkette sicher gespeichert. Zur Weitergabe der Erbinformation werden die Wasserstoffbrücken aufgebrochen und eine exakte Kopie der DNA synthetisiert. Daraus entstehen in einer komplexen Folge biochemischer Reaktionen letztendlich Eiweiße als Bestandteile der Zellen.
Angesichts dieser Beispiele (Anomalie des Wassers, Struktur von Eiweißen, DNA) wird klar, dass Wasserstoffbrückenbindungen für das Leben auf der Erde von essenzieller Bedeutung sind. Aber auch bei Säure-Base-Reaktionen, der Bindung von Farbstoffen auf Textilien und vielen weiteren chemischen Prozessen spielen diese besonderen zwischenmolekularen Kräfte eine wichtige Rolle.
-
Zwischen Cytosin und Guanin werden drei, zwischen Thymin und Adenin dagegen nur zwei (rot markierte) Wasserstoffbrückenbindungen ausgebildet.
VAN-DER-WAALS-Kräfte
Eine schwächere, aber trotzdem häufige Art von Wechselwirkungen zwischen Molekülen oder Edelgasatomen sind die nach einem niederländischen Physiker benannten VAN-DER-WAALS-Kräfte . Diese unterteilt man je nach Art der wechselwirkenden Teilchen in:
| – | Dipol-Dipol-Kräfte |
| – | Wechselwirkungen zwischen unpolaren und Dipolmolekülen |
| – | Wechselwirkungen zwischen unpolaren Molekülen bzw. Atomen |
Aufgrund der unterschiedlichen Elektronegativität der Atome in einem Molekül bilden sich polare Atombindungen aus. Daraus ergibt sich in vielen Fällen (z. B. Wasser, Chlorwasserstoff) ein permanentes Dipolmoment des Moleküls. Permanente Dipole richten sich ohne äußeren Einfluss entsprechend der elektrostatischen Anziehung ihrer Ladungsschwerpunkte aus. Um diese Anziehung zu überwinden, müssen in der Regel weniger als 20 kJ/mol aufgebracht werden.
-
Dipol-Dipol- Wechselwirkungen zwischen Chlorwasserstoffmolekülen
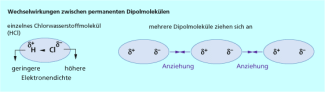
Unter dem Einfluss eines äußeren elektrischen Feldes verschiebt sich das Elektronensystem von Molekülen. Auf diese Weise werden selbst an sich unpolare Moleküle zu Dipolen. Man spricht von einem induzierten Dipolmoment , das sogar schon unter dem Einfluss des elektrischen Feldes eines anderen permanenten Dipols ausbildet. Auch diese unterschiedlichen Dipole ziehen sich an.
Selbst an sich völlig unpolare Teilchen wie Wasserstoffmoleküle oder Heliumatome treten untereinander in Wechselwirkung. Durch kurzzeitige unsymmetrische Verteilungen der Elektronenwolken kommt es ebenfalls dazu, dass den normalerweise unpolaren Teilchen kurzzeitig Dipolmomente induziert werden. Daraus resultieren weitere temporäre induzierte Dipolmomente von benachbarten Teilchen, die sich untereinander schwach anziehen. Dabei handelt es sich um einen dynamischen Prozess, weil die Dipolmomente sich ständig verändern.
Je größer das Elektronensystem von Atomen oder Molekülen ist, desto leichter lässt es sich deformieren. Aus diesem Grund kann beispielsweise Xenonatomen ein höheres Dipolmoment induziert werden als Heliumatomen, sodass Xenon einen höheren Siedepunkt als Helium aufweist. Aufgrund der VAN-DER-WAALS-Kräfte zwischen unpolaren Molekülen lassen sich die Edelgase bei tiefen Temperaturen überhaupt verflüssigen.
-
Auch zwischen unpolaren Molekülen wirken anziehende und abstoßende VAN-DER-WAALS-Kräfte.

Auch zwischen Makromolekülen von Kunststoffen oder innerhalb einer Peptidkette kommt es zu VAN-DER-WAALS-Wechselwirkungen, die die räumliche Struktur und somit die Eigenschaften der Stoffe beeinflussen.
-
Bindungsarten zur Ausbildung der Tertiärstruktur von Eiweißen