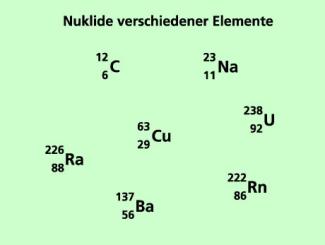
Nuklide und Isotope
Ein Nuklid ist ein Atomkern, der eindeutig durch Massenzahl und Kernladungszahl charakterisiert ist. Der Begriff wurde 1950 international eingeführt, um dem unkorrekten Gebrauch des Wortes Isotop entgegenzuwirken. Isotope sind Atomkerne eines Elements mit gleicher Protonenzahl, aber unterschiedlicher Anzahl von Neutronen. Es sind spezielle Nuklide. Wegen der gleichen Protonenzahl (= Kernladungszahl) haben Isotope auch die gleiche Anzahl von Elektronen in der Hülle.
Nuklide
Im Periodensystem der Elemente findet man heute 111 Elemente. Davon kommen 91 in der Natur vor, die übrigen werden künstlich hergestellt. Ein bestimmter Atomkern eines Elements ist eindeutig durch die Massenzahl (Anzahl von Protonen Z und Neutronen N) und die Kernladungszahl (Ordnungszahl im Periodensystem, Anzahl von Protonen und von Elektronen im neutralen Atom) gekennzeichnet.
Ein Atomkern, der eindeutig durch Massenzahl und Kernladungszahl charakterisiert ist, wird als Nuklid bezeichnet.
Der Begriff wurde 1950 international eingeführt, um einerseits Kernarten eindeutig zu kennzeichnen und andererseits dem unkorrekten Gebrauch des Wortes Isotop entgegenzuwirken. Ein Beispiel für ein Nuklid ist Natrium-23, in Symbolschreibweise .
Die Kernladungszahl, also die Anzahl der Protonen, beträgt 11. Die Massenzahl, also die Anzahl der Protonen und Neutronen im Kern, beträgt 23. Damit ergibt sich eine Neutronenzahl von 23 - 11 = 12. Weitere Nuklide sind beispielsweise . Solche Nuklide sind natürlich auch . Es sind Nuklide eines Elements.
Bei Nukliden kann man zwischen stabilen Nukliden und radioaktiven Nukliden, auch Radionuklide genannt, unterscheiden. Radioaktive Nuklide zerfallen unter Aussendung radioaktiver Strahlung. Bekannt sind heute insgesamt etwa 300 stabile und über 2.400 radioaktive und damit instabile Nuklide mit sehr unterschiedlichen Halbwertszeiten.
-
Ein Nuklid ist eindeutig durch Massenzahl und Kernladungszahl charakterisiert.
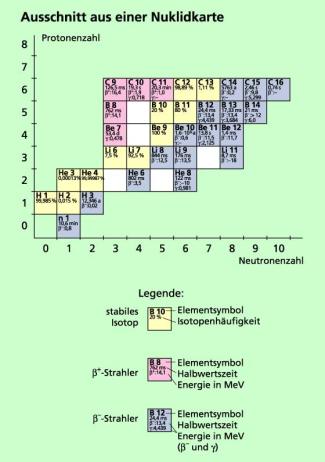
Nuklidkarten
Trägt man auf einer vertikalen Achse die Kernladungszahl des jeweiligen Atomkerns und auf der horizontalen Achse die Neutronenzahl auf, so erhält man eine übersichtliche Darstellung über die Atomkerne, die zu den verschiedenen Elementen gehören. Eine solche Darstellung wird als Nuklidkarte bezeichnet. Bild 2 zeigt einen Ausschnitt aus einer Nuklidkarte.
In der Horizontalen nebeneinander findet man die Nuklide des jeweiligen Elements. Beispielsweise hat Kohlenstoff (Kernladungszahl = Protonenzahl 6) acht verschiedene Nuklide. Untereinander stehen jeweils die Nuklide mit gleicher Neutronenzahl. Darüber hinaus gibt man häufig zu den einzelnen Nukliden noch an,
| ob es stabile oder radioaktive Nuklide sind, | |
| welche Art der Strahlung bei Radionukliden abgegeben wird, | |
| wie groß die Halbwertszeit ist, | |
| in welchen Anteil Nuklide eines Elements vorkommen. |
Bei Kohlenstoff (Protonenzahl 6, siehe Bild 2) sind von den 8 Nukliden 2 stabil, 6 sind instabil und zerfallen teils unter Aussendung von Elektronen und teils unter Aussendung von Positronen. Das Nuklid mit der größten Halbwertszeit ist Kohlenstoff-14 (C-14) mit einer Halbwertszeit von 5.760 Jahren. Dieses Radionuklid nutzt man übrigens zur Altersbestimmung organischer Stoffe (C-14-Methode).
Die bekannteste und umfassendste Nuklidkarte ist die sogenannten Karlsruher Nuklidkarte , die weitgehend vollständig alle bekannten Nuklide umfasst. In Lehrbüchern und Tabellenwerken findet man meist nur einen Ausschnitt aus dieser umfassenden Nuklidkarte.
-
Ausschnitt aus einer Nuklidkarte
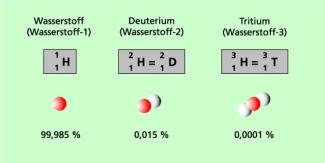
Isotope
Atomkerne eines Elements mit gleicher Protonenzahl , aber unterschiedlicher Neutronenzahl werden als Isotope bezeichnet. Es sind folglich spezielle Nuklide, nämlich die eines Elements. Wegen der gleichen Protonenzahl (= Kernladungszahl) haben Isotope auch die gleiche Anzahl von Elektronen in der Hülle. Aus der Definition wird schon deutlich, dass man auf den Begriff Isotop verzichten könnte; er wird traditionsgemäß aber auch heute noch für die Kennzeichnung der Atomkerne jeweils eines Elements verwednet.
So existieren z. B. beim Wasserstoff drei in der Natur vorkommende Isotope, die als Wasserstoff, Deuterium und Tritium bezeichnet werden. Es gibt nur etwa 20 Elemente, die nur aus einem einzigen stabilen Isotop bestehen. Dazu gehören beispielsweise:
Die meisten Elemente bestehen aus einem Isotopengemisch , wobei die Anteile der einzelnen Isotope sehr unterschiedlich sein können. So hat z. B. Uran, das als Kernbrennstoff genutzt wird, drei in der Natur vorkommende stabile Isotope mit folgenden Anteilen bei natürlichen Uranvorkommen:
| Uran-238: | 99,28 % | |
| Uran-235: | 0,72 % | |
| Uran-234: | 0,006 % |
Für Brennelemente in Kernkraftwerke nutzt man angereichertes Uran mit folgender Zusammensetzung:
| Uran-235: | 3,3 % | |
| Uran-238: | 96,7 % |
Bei Kupfer betragen die Anteile der stabilen Isotope:
| Kupfer-63: | 69,1 % | |
| Kupfer-65: | 30,9 % |
Die meisten stabilen Isotope hat Zinn (10), die meisten Isotope überhaupt sind beim Xenon bekannt (mindestens 24). Außer in der Neutronenzahl und damit in der Masse unterscheiden sich die Isotope eines Elements im Kernvolumen und bei leichten Elementen im chemischen Verhalten.
Wie bei Nukliden kann man stabile Isotope und radioaktive Isotope , auch Radioisotope genannt, unterscheiden.
Die Massen von Isotopen eines Elements unterscheiden sich in der Regel nur sehr wenig. Um Isotope voneinander zu trennen, gibt es verschiedene Verfahren der Isotopentrennung , beispielsweise die Trennung in Ultrazentrifugen, in Massenspektrografen, durch Elektrolyse oder Thermodiffusion.
-
Isotope des Wasserstoffs und ihre Anteile in der Natur