Brennstoffzelle
Brennstoffzellen sind technische Anordnungen, mit deren Hilfe aus Wasserstoff und Sauerstoff elektrischer Strom erzeugt werden kann, ohne dass Umweltbelastungen auftreten. Das Prinzip wurde bereits 1839 entdeckt. Intensive Forschungen zur technischen Nutzung begannen aber erst ab etwa 1960. Gegenwärtig ist die Entwicklung leistungsfähiger Brennstoffzellen ein Schwerpunkt der technischen Forschung.
Brennstoffzellen sind technische Anordnungen, mit deren Hilfe aus Wasserstoff und Sauerstoff elektrischer Strom erzeugt werden kann.
Entdeckung des Grundprinzips
Bereits 1839 demonstrierte der englische Astronom und Physiker WILLIAM GROVE (1811-1896) im Labor die prinzipielle Wirkungsweise einer Brennstoffzelle: Elektrolytisch erzeugter Wasserstoff und Sauerstoff wird Elektroden aus Platin zugeführt. Dabei bildet sich zum einen Wasser, zum anderen entsteht zwischen den Elektroden eine Spannung, die zu einem Strom führt.
Die Entwicklung einer leistungsfähigen elektrischen Quelle erwies sich allerdings als so schwierig, dass dieses Konzept nicht weiter verfolgt wurde. Hinzu kommt, dass mit der Entdeckung des elektrodynamischen Prinzips im Jahre 1866 durch WERNER VON SIEMENS (1816-1892) die Konstruktion von Dynamomaschinen möglich wurde, mit denen ausreichende Mengen elektrischer Energie erzeugt werden konnten.
Moderne Brennstoffzellen
Erst als elektrische Quellen für U-Boote und für Raumfahrzeuge gewannen Brennstoffzellen wieder an Bedeutung. Sie wurden erstmals 1965 in der Raumfahrt als Energiequellen genutzt. Heute wird daran gearbeitet, sie als Energielieferanten für Elektroautos und sogar in Kraftwerken einzusetzen.
Aufbau und Wirkungsweise
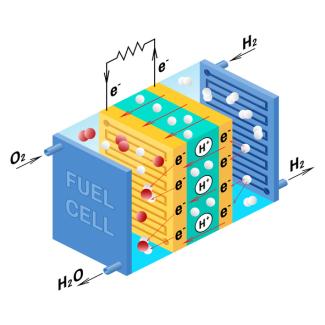
Die Brennstoffzelle besteht aus zwei Elektroden und einem Elektrolyten.
Die Anode wird mit dem Brennstoff, meist Wasserstoff, und die Katode mit Sauerstoff versorgt. Der Elektrolyt verbindet die beiden Elektroden miteinander. Bei einer Betriebstemperatur zwischen 80 °C und 1000 °C gibt Wasserstoff an der Anode (Minuspol) Elektronen ab:
Die frei gewordenen Elektronen fließen über einen Verbraucher zur Katode und können dabei Arbeit verrichten.
An der Katode nimmt Sauerstoff Elektronen auf. Sauerstoff-Ionen bewegen sich durch den Elektrolyten zur Anode und vereinigen sich dort mit Wasserstoff-Ionen zu Wasser:
Als Gesamtreaktion entsteht aus Wasserstoff und Sauerstoff Wasser. Eine einzelne Zelle liefert eine Spannung von 0,6 V bis 0,9 V. Durch Reihenschaltung solcher Zellen erreicht man Spannungen bis etwa 200 V.
Der Vorteil von Brennstoffzellen besteht vor allem darin, dass bei ihrem Betrieb keine Umweltbelastungen auftreten. Darüber hinaus ist ihr Wirkungsgrad mit 35 % bis 85 % sehr hoch.
Der derzeitige Nachteil von Brennstoffzellen besteht vor allem in den hohen Produktionskosten.
-
Brennstoffzellen-Diagramm
Ser_igor - GettyImages

