Gesetz von Gay-Lussac
Unter der Bedingung, dass der Druck in einem Gas konstant ist und sich das Gas wie das ideale Gas verhält, gilt:
Je höher die Temperatur eines Gases ist, desto größer ist sein Volumen.
Dieses Gesetz wurde erstmals 1802 von dem französischen Chemiker und Physiker JOSEPH LOUIS GAY-LUSSAC (1778-1850) formuliert.
In einem abgeschlossenen Wohn- oder Arbeitsraum herrscht der jeweilige Luftdruck, der sich nur in geringen Grenzen verändert. Bei einer bestimmten Temperatur hat die Luft im Raum ein bestimmtes Volumen. Wenn sich die Temperatur der Luft ändert, z. B. beim Aufdrehen der Heizung, ändert sich auch das Volumen der Luftmenge, die ursprünglich im Raum war. Da sich der Raum nicht vergrößert, strömt ein Teil der Luft aus bzw. bei Verringerung der Temperatur in den Raum hinein.
-
Die Luft in einem Raum hat ein bestimmtes Volumen.

L. Meyer, Potsdam
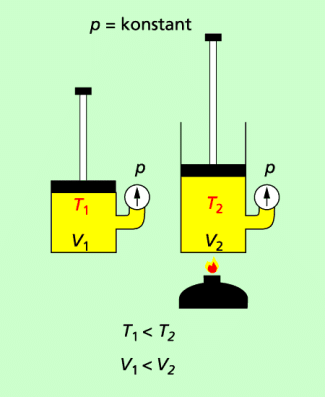
Je höher die Temperatur ist, desto größer ist bei einem bestimmten Druck das Volumen, das eine bestimmte Gasmenge einnimmt. Unter der Bedingung, dass der Druck in einem Gas konstant ist und sich das Gas wie das ideale Gas verhält, gilt:
Das Gesetz wurde erstmals 1802 von dem französischen Chemiker und Physiker JOESPH LOUIS GAY-LUSSAC (1778-1850) formuliert und wird heute als Gesetz von GAY-LUSSAC oder auch als Volumen-Temperatur- Gesetz bezeichnet. Dieses Gesetz ist ein Spezialfall der Zustandsgleichung für das ideale Gas. Da bei dem betrachteten Vorgang der Druck des Gases konstant bleibt, sich aber bei Erwärmung Temperatur und Volumen ändern, spricht man in der Physik auch von einer isobaren Zustandsänderung des Gases.
-
Bei konstantem Druck gilt: Je höher die Temperatur, desto größer das Volumen.
Beispiele für das Wirken des Gesetzes
Beispiel für das Wirken des Gesetzes von GAY-LUSSAC sind Gasthermometer oder Räume und Gefäße, in denen näherungsweise ein konstanter Druck herrscht und bei denen sich die Temperatur des eingeschlossenen Gases ändert.
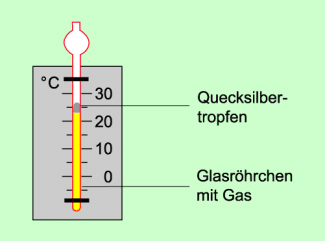
Die Volumenänderung bei Temperaturänderung wird bei Gasthermometern genutzt (Bild 3). In einem Glasröhrchen befindet sich ein Gas, im einfachsten Falle Luft. Das Gas ist durch einen Quecksilbertropfen abgeschlossen. Der Quecksilbertropfen wirkt mit seiner Gewichtskraft auf das eingeschlossene Gas. Dadurch besteht im Gas ein bestimmter, konstanter Druck.
Vergrößert sich die Temperatur, so vergrößert sich proportional dazu das Volumen des eingeschlossenen Gases. Der Quecksilbertropfen steigt demzufolge nach oben. Bei Verringerung der Temperatur verkleinert sich das Volumen des eingeschlossenen Gases. Der Quecksilbertropfen sinkt nach unten. Die Höhe des Quecksilbertropfens ist somit ein Maß für die jeweilige Temperatur. Bringt man eine Skala an und eicht das Thermometer, so kann man die jeweilige Temperatur in Höhe des Quecksilbertropfens ablesen.
Bei Wohnräumen ist der Druck gleich dem Luftdruck. Bei einer bestimmten Temperatur befindet sich in einem solchen Raum eine bestimmte Menge Luft. Wird durch Heizen die Temperatur erhöht, so nimmt die Luftmenge ein größeres Volumen ein. Da sich die Raumgröße nicht ändert, strömt ein Teil der Luft aus. Umgekehrt verringert sich bei Verringerung der Temperatur das Volumen einer bestimmten Gasmenge. In einen Raum würde dann von außen Luft einströmen.
-
Aufbau eines Gasthermometers