Aluminium als Gebrauchsmetall
Aluminium ist heute nach Eisen das bedeutendste Gebrauchsmetall. Ursache dafür ist sein außergewöhnliches Eigenschaftsspektrum. Insbesondere die geringe Dichte hilft bei der Treibstoff- und Energieeinsparung im Verkehrssektor. Dabei ist Aluminium zugleich extrem fest, sehr langlebig und witterungsbeständig. Von Nachteil sind die enorm hohen Energieaufwendungen für die Produktion von Aluminium aus dem Erz Bauxit. Glücklicherweise ist Aluminium in besonderem Maße recyclingfähig, wobei bis zu 95% des Energieaufwands eingespart werden können.
Eigenschaften von Aluminium
Aluminium ist ein außergewöhnlich vielseitig verwendbarer Werkstoff und nach Eisen heute das meistgenutzte Gebrauchsmetall. Ursache dafür ist sein außergewöhnliches Eigenschaftsspektrum:
- geringe Dichte (Gewichtseinsparung)
- extrem hohe Festigkeit
- außerordentliche Langlebigkeit
- gute Leitfähigkeit für elektrischen Strom und Wärme
- Korrosions- und Witterungsbeständigkeit
- Undurchlässigkeit für Gase, Flüssigkeiten (woraus eine enorme Beständigkeit gegen Umwelteinflüsse resultiert)
- leichte Bearbeitbarkeit
- hohe Wirtschaftlichkeit in der Herstellung, Montage und Nutzung von Aluminiumprodukten.
- ausgezeichnete Wiederverwertbarkeit ausgedienter Aluminiumprodukte (Sekundäraluminium).
Anwendungsspektrum
Aluminium findet in nahezu allen Gebieten der Technik und des täglichen Lebens Anwendung. Der größte Teil geht in die Märkte Verkehr, Bau und Verpackung.
Sein geringes Gewicht überzeugt vor allem im Verkehrssektor wo es gilt Treibstoff bzw. Energie zu sparen – ob als Motorblock oder Zylinderkopf im Pkw, als Fahrwerksgestell, als ICE-Mittelwagen oder im Flugzeugbau. Beim Airbus A 340 sind zwei Drittel der verbauten Materialien aus Aluminium. Dadurch wiegt er „nur“ etwa 90 000 kg.
Im Bauwesen ist die Langlebigkeit und Wartungsfreiheit von Fenstern, Fassaden und Dächern aus Aluminium gefragt. Seit über 100 Jahren glänzt die Dachkuppe der römischen Kirche San Gioacchino, die aus Aluminiumprofilen gefertigt wurde.
In der Verpackung schützt Aluminium aufgrund seiner Barriereeigenschaft Lebensmittel und Pharmazeutika. Selbst als hauchdünne Folie wirkt es schützend gegen Licht, Gas, Dampf und Keime.
Seine gute Leitfähigkeit macht es für die Elektrotechnik interessant.
Rucksacktouristen schätzen die Leichtigkeit verschiedener Gestelle aus Aluminium. Alutöpfe sind gute Wärmeleiter, Alu-Räder erhöhen den Freizeitspaß genauso wie Kickbords oder Skooter. Viele Design- und Gebrauchsobjekte bestehen aus Alu.
Das Spektrum lässt sich fast unbegrenzt erweitern.
Eloxalverfahren
Das unedle Metall überzieht sich bereits an der Luft mit einer dünnen durchsichtigen Oxidschicht (bis zu 0,003 mm), die das darunter liegende Metall vor weiterer Korrosion schützt. (Passivierung) Diese Schicht wird technisch durch das elektrolytische Eloxal-Verfahren verstärkt.
Das Werkstück aus Aluminium wird dazu in einer Elektrolyseapparatur als Anode geschaltet, die Katode besteht aus Blei oder ebenfalls Aluminium. Als Elektrolyt kommt meist Schwefelsäure oder Oxalsäure zum Einsatz. An der Oberfläche des Aluminiums werden dabei gebildet, die durch feine Poren in der natürlichen Oxidschicht in Kontakt mit der Elektrolytlösung gelangen, wo sie dann mit Wasser zu Aluminiumoxid reagieren. Dabei erhöht sich die Dicke der Oxidschicht um den Faktor 10 auf ca. 0,03 mm.
Einfluss des Elektrolyten auf die Oberflächenstruktur
Die Oberflächenstruktur hängt von der Art des Elektrolyten ab.
Verwendet man Schwefelsäure, kommt es durch die starke Säure zur teilweisen Wiederauflösung der gebildeten Oxidschicht, die dann im Verlauf der Elektrolyse immer wieder nachgebildet wird. Dadurch entsteht eine Vielzahl kleiner dicht nebeneinanderliegender Poren und hat daher eine wabenartige Struktur. Das Material bleibt stromdurchlässig.
Verwendet man die schwächere Oxalsäure, als Elektrolyt, kommt es nur in viel geringerem Maße zur Wiederauflösung der gebildeten Oxidschicht. Es entstehen daher dichtere, porenärmere Oxidschichten von großer Härte, die zudem einen hohen elektrischen Widerstand aufweisen.
Mit heißem Wasserdampf kann man vorhandene Poren schließen. Dabei bilden sich Aluminiumhydroxid-Gele und die Oxidschicht wird verdichtet. Da die Schicht durchsichtig ist, bleibt der Glanz der metallischen Oberfläche erhalten und bietet sehr guten Schutz. Selbst aggressive Substanzen wie Schwefeldioxid greifen diese kaum an.
Beim Waschen mit kaltem Wasser bleibt die Porenstruktur weitgehend erhalten. Sie kann daher gut Farbstoffe einlagern. Besonders eignen sich saure Farbstoffe, da das beim Waschen mit kaltem Wasser zum Teil gebildete Aluminiumhydroxid, saure organische Farbstoff unter Komplexbildung gut binden kann.
Energiebedarf zur Aluminiumherstellung und Recycling
Der Energiebedarf für die Herstellung von Aluminium durch Schmelzfluss-Elektrolyse ist extrem hoch. Allein für den Elektrolyseprozess benötigt man 13 - 15 MWh je Tonne Aluminium. Das entspricht etwa dem durchschnittlichen Jahresverbrauch an elektrischer Energie von 5 - 10 Haushalten. In Deutschland werden 2 - 3% der gesamten elektrischen Energie allein für die Aluminium - Schmelzflusselektrolyse eingesetzt. Daher wird Aluminium weltweit in großem Umfang in solchen Ländern produziert, wo elektrische Energie preiswert durch Wasserkraft erzeugt werden kann (z. B. Norwegen, Südamerika).
Rechnet man noch den Energiebedarf zur Herstellung des Aluminiumoxids aus Bauxit in Form von elektrischer und thermischer Energie hinzu, so ergibt daraus sich ein Gesamtenergieverbrauch von rund 40 MWh je Tonne Aluminium. Der Gesamtenergiebedarf zur Herstellung von 1 Tonne Glas beträgt dagegen nur etwa 3 MWh!
Recycling – Sekundäraluminium
Sekundäraluminium ist die Bezeichnung für Aluminium, das im Gegensatz zu dem durch Schmelzflusselektrolyse gewonnenem Primäraluminium (Hüttenaluminium) durch Umschmelzen von Aluminiumschrott gewonnen wird.
Prinzipiell kann man Aluminium sehr gut recyclen. Aluminiumschrott aus industriellen Anwendungen (Automobilindustrie, Elektroindustrie, Bauwesen), Haushalten (Getränkeverpackung) oder Produktionsabfälle (Drehspäne, Stanzabfälle) werden zur Verhinderung der Oxydation durch Luftsauerstoff in einer chloridhaltigen Salzschmelze zu Sekundäraluminium mit einer Reinheit von 96 - 98% bei 670 - 680°C eingeschmolzen. Nach weiterer Reinigung unterscheidet es sich in seiner Qualität nicht vom Primärmaterial.
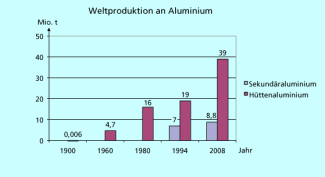
Der Energiebedarf für das Recycling ist sehr viel geringer als für die Gewinnung von Primäraluminium und beträgt nur 5-10 % dessen. Die Recyclingquoten sind je nach Anwendung sehr unterschiedlich, im Automobilbau liegen sie bei 90 %. Die Recyclingquote von Aluminium aus Bauwesen, Elektrotechnik und Verpackung beträgt in Europa 80-90 %. In Deutschland liegt die Recyclingrate insgesamt für Aluminium bei knapp 70 %. Im Jahr 2008 wurde in der BRD infolge des viel geringeren Energiebedarfs sogar mehr Sekundäraluminium (ca. 700 000 t) als Primärmaterial (ca. 600 000 t) erzeugt.
Ein Problem beim Recycling von gemischten Abfällen besteht in der Stofftrennung. Für aluminiumhaltige Verbundverpackungen (z. B. Saftkartons (Tetrapack)) gibt es noch keine völlig befriedigende Recyclingmethoden.
Insgesamt ist aber der Anteil an Sekundäraluminium am Verbrauch steigend, im Jahr 2008 wurden weltweit ca. 39 Millionen Tonnen Primäraluminium und 8,8 Millionen Tonnen Sekundäraluminium erzeugt. In der deutschen Aluminiumproduktion hat das Sekundärmaterial bereits einen Marktanteil von über 50 % (Bild 6).
Ohne Qualitätsverlust lassen sich aus Sekundäraluminium gleichwertige oder ähnliche Produkte herstellen, wie aus Primäraluminium.
-
Der Anteil des Sekundäraluminiums an der Weltproduktion nimmt immer weiter zu.