Komplexreaktionen
Komplexverbindungen unterscheiden sich durch ihren Aufbau und besondere Eigenschaften von gewöhnlichen Ionenverbindungen. Aufgrund ihrer Farbigkeit und besonderen Löslichkeit werden sie als Nachweisreagenzien in der chemischen Analytik eingesetzt. Auch in der Natur spielen Komplexverbindungen eine wichtige Rolle, so z. B. das Hämoglobin beim Sauerstofftransport im Blut und das Chlorophyll bei der Fotosynthese.
Komplexverbindungen sind häufig Salze, die aus einem komplexen Ion und einem entgegengesetzt geladenen Gegen-Ion bestehen. Das Komplexteilchen setzt sich aus einem Zentralion und den Liganden zusammen. Liganden sind ebenfalls Moleküle oder Ionen, die sich mit ihren freien Elektronenpaaren an das Zentralion anlagern. Die Anzahl der direkt an das Zentralteilchen gebundenen einzähnigen Liganden heißt Koordinationszahl. Häufige Koordinationszahlen sind 2, 4 und 6. In Komplexen mit 4 und mehr Liganden verfügen die Zentral-Ionen damit über mehr als 8 Valenzelektronen.
Ihr Entdecker, der Schweizer Chemiker ALFRED WERNER nannte sie deshalb auch „Verbindungen höherer Ordnung“. Gebräuchlich ist auch die Bezeichnung Koordinationsverbindungen.
Kationische Zentralionen sind meistens Metall-Ionen, z. B. Besonders die Nebengruppenelemente sind gut als Zentralionen geeignet:
Die Liganden werden in mehrere Gruppen unterteilt.
![]()
Man unterscheidet die Komplexe in anionische und kationische Komplexe, je nach Ladung des komplexen Ions:
Anionische Komplexe
| – | |
| – | |
| – | |
| – | |
| – | sowie |
| – | . |
Die Salzbildung erfolgt vorzugsweise mit kationischen Gegen-Ionen des Typs:
Kationische Komplexe:
| – | |
| – | |
| – | |
| – |
Salze werden u.a. mit den anionischen Gegenionen gebildet.
Die Bindungsverhältnisse in Komplexen unterscheiden sich von der gewöhnlichen Atombindung bzw. Ionenbindung. Man beschreibt die Bindung in Komplexen mit verschiedenen Modellen. Das einfachste Modell geht davon aus, dass die Liganden als Elektronepaardonatoren dem Zentralion als Elektronenpaarakzeptor ein freies Elektronenpaar zur Verfügung stellen. Diese Bindungsart wird als dative oder koordinative Bindung bezeichnet.
-
Aufbau einer Komplexverbindung

Bildung von Komplexen
Die einfachste Art der Komplexbildung besteht darin, Salze von Übergangsmetallen in Wasser zu lösen. Wasser ist ein Dipol und lagert sich als Elektronenpaardonator an das Metall-Ion an. Dabei beobachtet man oft eine Farbänderung.
Viele anionische Komplexe und deren anorganische Salze werden durch Umsetzung der Salze (z. B. Halogenide, Carbonate) des Zentralatoms mit den Ligandenträgerverbindungen hergestellt:
Ebenso sind Austauschreaktionen innerhalb von bestehenden Komplexen möglich. So können z. B. der Ligand Wasser an Kupfer(II)-Ionen sehr leicht durch Ammoniak ersetzt werden. Die dabei auftretende Farbänderung wird zum Nachweis der Kupfer(II)-Ionen in wässriger Lösung genutzt:
Eigenschaften von Komplexen
Bei der Bildung der Komplexteilchen treten neben der Farbänderung noch weitere Eigenschaftsänderungen auf. Die Eigenschaften des Komplexes unterscheiden sich oft deutlich von denen der freien, unkomplexierten Zentralionen und Liganden . Typische Änderungen sind:
- Verringerung der Leitfähigkeit, da durch das komplexe Anion weniger freie Ionen vorhanden sind;
- Umkehrung der elektrischen Ladung von positiv nach negativ;
- Änderung der magnetischen Eigenschaften;
- Änderungen der Farbigkeit durch Unterschied zwischen klassischer Ionenbindung und der Bindung in Komplexen
- Änderungen der Löslichkeit bzw. Schwerlöslichkeit von Salzen
Mit Hilfe von Leitfähigkeitsmessungen lässt sich untersuchen, ob sich ein Komplex gebildet hat, denn die elektrische Leitfähigkeit einer Lösung hängt u. a. davon ab, in wie viele Ionen ein Salz dissoziiert. Ist die Summe der elektrischen Leitfähigkeiten der Einzellösungen wesentlich größer als die elektrische Leitfähigkeit der Mischung, haben die Ionen in der Lösung einen Komplex gebildet und dadurch die Anzahl der Ionen verringert, die frei in der Lösung vorliegen.
Außerdem ändert sich die Wanderungsrichtung der Eisen-Ionen im elektrischen Feld. Das freie, nicht komplexierte ist ein Kation und würde zur Katode wandern. Durch die Bildung von Komplexen ist es in einem Anion gebunden und wandert im elektrischen Feld zur anderen Elektrode, der Anode.
Durch Komplexbildung ändert sich auch die Löslichkeit schwer löslicher Salze. Wird Silbernitratlösung mit etwas Salpetersäure angesäuert und danach ein Tropfen Kochsalzlösung zugegeben, fällt weißes Silberchlorid aus. Dies ist ein schwer lösliches Salz, welches beispielsweise durch Verdünnen mit Wasser nicht wieder in Lösung gebracht werden kann. Gibt man jedoch Ammoniak-Lösung hinzu, löst sich der weiße Niederschlag auf. Silber-Ionen gehen mit Ammoniak einen stabilere Verbindung ein als mit Chlorid-Ionen. Es entstehen in Wasser lösliche Diamminsilber(I)-Ionen.
-
Ionen in wässriger Lösung im elektrischen Feld
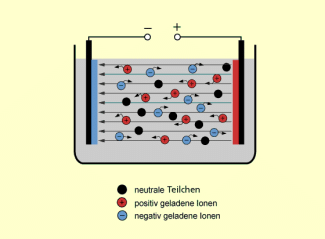
Auch diese Eigenschaft der Komplexe wird bei chemischen Nachweisreaktionen genutzt.
Bedeutung von Komplexverbindungen
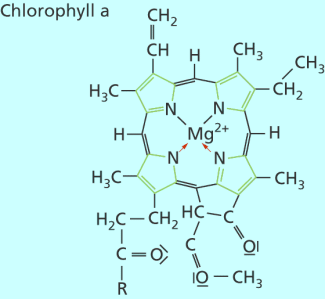
In der Natur sind die Komplexverbindungen von großer Bedeutung. Hämoglobin , der rote Farbstoff im Blut, besteht aus vier gefalteten Polypeptidketten, von denen jede im Innern einen Häm-Komplex gebunden hat. Im Häm-Komplex ist ein Eisen(II)-Ion als Zentral-Ion zu finden. Auch Myoglobin, Vitamin B12 und Chlorophyll sind Komplexverbindungen.
In der Waschmittelindustrie wurden vor nicht allzu langer Zeit vor allem Phosphatkomplexe gegen zu hartes Wasser eingesetzt. Ihr Nachteil besteht darin, dass sie sich ungünstig auf die Nährstoffbilanz von Gewässern auswirken und so zu einer Schädigung der Umwelt führen können. Daher werden sie heute häufig durch andere Substanzen ersetzt.
Weitere Anwendungen finden Komplexe in der Fotografie, sowie als Katalysatoren in der Technik und - wie oben beschrieben - als Nachweisreagenzien in der chemischen Analytik.
-
Struktur des Chlorophyll