Seifen
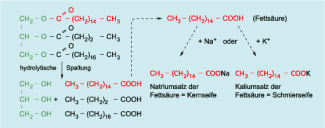
Seifen entstehen durch Spaltung von Fetten, den Estern des Glycerols (Glycerin) mit langkettigen Carbonsäuren mittels Natriumhydroxid- oder Kaliumhydroxiglösung.
Es entstehen neben Glycerol die entsprechenden Salze der Fettsäure. Diese Natrium- und Kaliumsalze bezeichnet man als Seifen. Sie sind durch ganz besondere Eigenschaften gekennzeichnet und dadurch als Waschmittel geeignet.
Moderne Waschmittel sind eine Weiterentwicklung der einfachen Seifen. Ihre Waschkraft beruht auf fünf Gruppen von Inhaltsstoffen: Tenside, Bleichsysteme, Waschmittelenzyme, optische Aufheller und Weichspüler.
Historisches
Zu Beginn des 20. Jh. wurde das erste Vollwaschmittel produziert. Doch schon lange davor verwendeten Menschen Seifen zum Waschen ihres Körpers und der Kleidung.
Schon im Altertum kannten die Ägypter Stoffe, die sie zur Reinigung von Wäsche nutzten. Sie erhitzten Fette mit Soda (Natriumcarbonat) und erhielten Seife.
Die Germanen, Gallier, Griechen und Römer verwendeten die Seife vorwiegend zum Waschen von Kleidungsstücken.
Im Mittelalter blühte das Handwerk der Seifensiederei.
In großen Bottichen aus Holz wurde tierisches Fett, z.B. Rindertalg, mit Pottasche oder Soda bei höheren Temperaturen mit großen Holzlöffeln verrührt.
Bereits damals wurden der entstehenden Rohseife Duftstoffe zugesetzt, die aus der Natur gewonnen wurden.
Auf diese Weise erhielt man parfürmierte Seife.
Im 19. Jh. reichte die in Handwerksbetrieben produzierte Seife für den Bedarf der Menschen nicht mehr aus. Die industrielle Produktion von Seife begann. Ein Jahrhundert später wurde die Seife zum Reinigen von Wäsche durch Seifenpulver abgelöst.
Die synthetische Herstellung von Waschmitteln in großer Menge setzte ein. Die Waschwirkung und andere Eigenschaften von Waschmitteln wurden und werden ständig verbessert.
Seifen - eine Stoffgruppe
Als Verseifung wird die Spaltung von Estern mit Wasser unter dem Einfluss von basischen Lösungen bezeichnet.
Bei der Verseifung von pflanzlichen oder tierischen Fetten und Ölen erhält man Glycerol und die Salze der entsprechenden Fettsäuren.
Kaliumsalze und Natriumsalze der Fettsäuren mittlerer und höherer Kettenlänge sind Seifen.
Bei den Seifen handelt es sich also nicht um einen Stoff, sondern um eine ganze Stoffgruppe.
Reagieren Fette oder auch Fettsäuren mit Kaliumhydroxidlösung, so bilden sich die Kaliumsalze der Fettsäuren, welche auch als Schmierseifen bezeichnet werden.
Setzt man Natriumhydroxidlösung ein, so entstehen Natriumsalze der Fettsäuren. Diese heißen Kernseifen.
Die meisten natürlich vorkommenden Fette bilden nach der Verseifung eine Mischung verschiedener Seifen.
Kalium-Seifen sind leichter in Wasser löslich, weicher und angenehmer auf der Haut als Natrium-Seifen. Beide können als Reinigungsmittel eingesetzt werden. Ihre Wirkung entfalten sie jedoch erst in der Lösung:
-
chemische Vorgänge bei der Herstellung von Seifen
Wirkung von Seifen
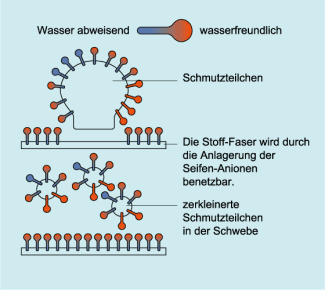
Die Wirkung beruht auf dem Bau der Seifen-Anionen. Sie haben ein polares Ende (Carboxylat-Gruppe) mit einer negativen Ladung und ein unpolares Ende, das aus dem Rest der Fettsäure besteht. Diese Seifen-Anionen treten mit dem Wasser in Wechselwirkung.
Wasser ist ein Dipolmolekül. Die Anziehungskräfte zwischen den Wassermolekülen führen zu Wasserstoffbrückenbindungen und bedingen den Zusammenhalt der Flüssigkeit. Darum nimmt Wasser stets eine möglichst kleine Oberfläche ein. Es besitzt eine Oberflächenspannung.
Die Oberflächenspannung behindert die Waschwirkung reinen Wassers, da sich die Schmutzteilchen nicht lösen können.
Durch die Teilchen der Seifenlösung wird nun diese Oberflächenspannung herabgesetzt.
Die Seifen-Anionen lagern sich an der Wasseroberfläche an und durchstoßen mit ihrem „wasserfeindlichen“ Ende die Grenzfläche. Dadurch werden die Kräfte zwischen den Wassermolekülen herabgesetzt und die Oberflächenspannung nimmt ab.
Diese Eigenschaft der Seifen-Anionen heißt Grenzflächenaktivität. Durch diese Grenzflächenaktivität werden Stoffe und Gewebe überhaupt erst benetzbar, was eine wesentliche Voraussetzung für die Reinigung darstellt.
-
Schema der Struktur eines Seifen-Anions
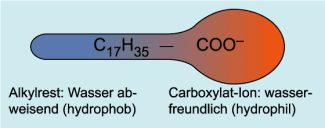
Die Wasser abstoßenden Enden der Seifen-Anionen dringen in die Schmutzteilchen ein. An der Oberfläche der Schmutzteilchen entstehen Ladungen, die sich abstoßen.
Die Schmutzteilchen werden so in der Schwebe gehalten und während des Spülvorgangs entfernt.
Diese Eigenschaft bezeichnet man als Waschaktivität.
Nachteile der Seifen
Neben ihrer Grenzflächen- und Waschaktivität haben Seifen auch Nachteile.
Naturfasern, wie Wolle und Seide, werden durch Seifenlösung geschädigt, denn Seifenlösungen reagieren basisch, die Tierfasern sind jedoch aufgrund ihrer Aminosäuren oft sauer. Die vorliegenden Hydroxid-Ionen wirken schädlich auf die Fasern.
In Gebieten mit sehr hartem Wasser benötigt man sehr viel Seife, ehe man überhaupt Schaum erhält.
Ursache dafür sind im harten Wasser die vielen Calcium-Ionen. Seifen-Anionen reagieren mit diesen Calcium-Ionen. Dabei bilden sich schwer lösliche Kalkseifen, die ausfallen und damit die Wirkung der Seifen-Anionen verhindern.
Die reinigende Wirkung der Seifen kann erst eintreten, wenn mehr Seifenlösung vorhanden ist, als für die Bildung der Kalkseifen verloren geht.
Moderne Waschmittel
Waschaktive Substanzen
Waschmittel werden zum Waschen von Textilien benötigt. Ihre Waschkraft beruht auf Stoffen, die genau wie die Seifen aus relativ großen Molekülen bestehen, welche jeweils ein polares (wasseranziehendes ) und ein unpolares (wasserabstoßendes) Ende haben.
Die Wirkungsweise der Seifen gilt auch für die sogenannten Tenside.
Unterschieden werden anionische Tenside mit einer negativen Gruppe, zu denen die Seifen gehören, nichtionische und kationische Tenside. Nichtionische Tenside mit einer positiven Gruppe im Molekül haben den Vorteil, dass sie nicht mit Calcium-Ionen des Wassers reagieren und den Seifen in dieser Hinsicht überlegen sind. Neben den Tensiden enthalten moderne Waschmittel häufig noch Bleichsysteme, Waschmittelenzyme, optische Aufheller und Weichspüler.
Zusatzstoffe in Waschmitteln
Das größte Problem beim Waschen sind die Calcium- und Magnesium-Ionen im Wasser (Wasserhärte). Jahrelang wurden den Waschmitteln deshalb Phosphate, besonders Pentanatriumtriphosphat, zugesetzt. Diese Phosphate hatten Anteil an der zunehmenden Überdüngung (Eutrophierung) der Gewässer. Darum wurden diese Stoffe durch Zeolith A oder Polycarboxylate ersetzt.
Als Bleichmittel werden Komponenten zur Entfernung von Verunreinigungen, wie Obst-, Kaffee- oder Teeflecken eingesetzt.
Diese Bleichmittel entfalten ihre volle Wirkung erst bei Temperaturen ab 90 °C aufwärts. Durch den zunehmenden Trend, bei niedrigeren Temperaturen zu waschen, benötigt man Bleichaktivatoren. Dazu werden N-Acetylverbindungen eingesetzt.
Enzyme in Waschmittel dienen dazu, organische Stoffe, wie Essensreste oder Blutflecken zu entfernen.
Optische Aufheller sind Substanzen, die mit dem Waschwasser auf dem Textilgut verteilt werden und dann den UV-Anteil aus dem Tageslicht der Sonne absorbieren und als blaues Fluoreszenzlicht wieder emittieren. Dadurch kommt es zu einem besonders strahlendem, „weißen“ Aussehen. Dieses Phänomen kann gut z.B. bei weißen T-Shirts unter besonderer Beleuchtung in Discos beobachten.
Weichspüler enthalten meistens kationische Tenside.
Baukastenprinzip
In einem Vollwaschmittel sind sehr viele dieser unterschiedlichen Substanzen enthalten. Sie sind aber nicht bei jeder Art Wäsche nötig. So gibt es auch Waschmittel nach dem Baukastenprinzip, mit denen man wesentliche Substanzen selbst zusammenstellen kann.
| Inhaltsstoff | Funktion | konventionelle Pulver | Kompakt-waschmittel |
| anionische und nichtionische Tenside | Schmutzlöser | 10-15% | 10-25% |
| Bleichmittel | z.B. zur Tee-, Rotwein- und Obstfleck-entfernung | 10-25% | 10-20% |
| Schaum-inhibitoren | Verhindern übermäßiges Schäumen | 0,1-4% | 0,1-2% |
| Enzyme | lösen eiweißhaltige Flecken |
0,3-0,8% | 0,5-2% |
| optische Aufheller | erhöhen die Weißkraft des Gewebes |
0,1-0,3% | 0,1-0,3% |
| Füllstoffe | z.B. Natriumsulfat, verhindert das Verklumpen des Waschmittels | 5-30% | keine% |
| Korrosions-inhibitoren | frischer Geruch | 2-6% | 2-6% |
| Wasserenthärter | 20-30% | 10-20% | |
| Duftstoffe | 0,1-0,2% | 0,1-0,2% |
-
Seifen-Anionen können durch ihren besonderen Bau Schmutzteilchen einschließen.Diese werden dadurch leicht entfernt.