Die Wärme
Die Wärme ist eine relativ komplizierte physikalische Größe, deren Wesen erst im Laufe vieler Jahrzehnte geklärt werden konnte. Heute kann man klar definieren: Die Wärme gibt an, wie viel thermische Energie von einem Körper auf einen anderen Körper übertragen wird.
| Formelzeichen: | Q |
| Einheit: | ein Joule (1 J) |
Die Wärme ist wie die mechanische Arbeit eine Prozessgröße, da sie den Prozess der Energieübertragung zwischen Körpern beschreibt.
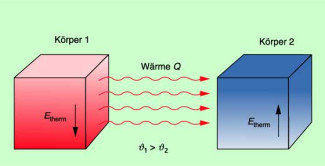
Wird von einem Körper Wärme abgegeben, so verringert sich seine thermische Energie. Die thermische Energie des Körpers, auf den die Wärme übertragen wird, vergrößert sich dementsprechend (Bild 1). Die Wärme ist somit ein Maß für die zugeführte oder abgegebene thermische Energie.
Benannt ist die Einheit der Wärme nach dem englischen Physiker JAMES PRESCOTT JOULE (1818-1889).
Vielfache der Einheit 1 J sind ein Kilojoule (1 kJ) und ein Megajoule (1 MJ):
| 1 kJ | = 1 000 J |
| 1 MJ | = 1 000 kJ = 1 000 000 J |
Früher wurden als Einheiten für die Wärme auch eine Kalorie (1 cal) und eine Kilokalorie (1 kcal) genutzt. Es gilt:
| 1 cal | = 4,19 J |
| 1 kcal | = 4,19 kJ |
Gebräuchlich ist für die Größe auch das Wort Wärmemenge, der in einer Zeit geprägt wurde, als man von der Existenz eines besonderes Wärmestoffes ausging. In der Technik ist es üblich, den Terminus „Wärmeenergie“ zu verwenden. In der Physik ist dieser Terminus nicht zweckmäßig, da in einem Wort die Bezeichnung für eine Prozessgröße (Wärme) und für eine Zustandsgröße (Energie) enthalten ist. Das ist ein Widerspruch in sich.
Gibt ein Körper Wärme ab, so verringert sich seine thermische Energie. Nimmt er Wärme auf, so vergrößert sich seine thermische Energie. Dabei gilt für den Zusammenhang zwischen abgegebenen bzw. aufgenommenen Wärme Q und der Änderung der thermischen Energie:
Die Wärme kennzeichnet den Prozess der Übertragung thermischer Energie von einem Körper auf einen anderen oder auch von einem Körper auf seine Umgebung. Sie wird deshalb als eine Prozessgröße bezeichnet.
Formen und Auswirkungen der Wärmeübertragung
Wärmeübertragung zwischen zwei Körpern oder einem Körper und seiner Umgebung erfolgt immer dann, wenn zwischen diesen Körpern oder einem Körper und seiner Umgebung eine Temperaturdifferenz besteht. Die Übertragung von Wärme kann dabei erfolgen durch
- Wärmeströmung, auch Konvektion genannt,
- Wärmeleitung,
- Wärmestrahlung.
Ausführliche Informationen zu den drei genannten Formen der Wärmeübertragung sind unter den betreffenden Stichwörtern zu finden.
Wird Wärme von einem Körper abgegeben oder von ihm aufgenommen, dann kann das folgende Auswirkungen haben:
- Die Temperatur des Körpers verringert oder erhöht sich.
- Der Aggregatzustand des Körpers ändert sich.
- Das Volumen des Körpers ändert sich.
- Der Druck im Körper ändert sich. Das gilt insbesondere für Flüssigkeiten und Gase in abgeschlossenen Gefäßen.
Zu allen diesen Auswirkungen gibt es gesonderte Beiträge auf der CD. Das gilt auch für den Wärmeausgleich, der zwischen zwei Körpern erfolgt, die in enger Verbindung miteinander stehen.
In vielen Fällen lässt sich die Wärme, die von Körpern aufgenommen oder abgegeben wird, mit der Grundgleichung der Wärmelehre berechnen. Diese lautet:
Unter der Bedingung, dass keine Aggregatzustandsänderung erfolgt, kann die von einem Körper aufgenommene oder abgegebene Wärme berechnet werden mit der Gleichung: