Nullter Hauptsatz der Thermodynamik
Das Streben nach thermischem Gleichgewicht durch Temperaturausgleich ist charakteristisch für thermodynamische Systeme. Es wird heute oft als nullter Hauptsatz der Thermodynamik bezeichnet, da diese Eigenschaft thermodynamischer Systeme Grundlage für viele Temperaturmessungen ist. Dieser Hauptsatz lautet:
Werden zwei thermodynamische Systeme (Körper) miteinander in Kontakt gebracht, so gleichen sich ihre Temperaturen in endlicher Zeit aus.
Die gleiche Temperatur bleibt auch nach der Trennung der Systeme erhalten, wenn keine Wärmeübertragung zwischen Systemen und Umgebung erfolgt.
Die Hauptsätze der Thermodynamik sind grundlegende Erfahrungssätze, die aus zahlreichen Beobachtungen und Messungen gewonnen wurden. Der Begriff "Hauptsatz" ist ein historischer Begriff, der zunächst nur für den ersten und zweiten Hauptsatz verwendet wurde. Verknüpfen doch diese beiden Hauptsätze der Thermodynamik durch ihre Allgemeingültigkeit die verschiedenen Teilgebiete der Physik miteinander.
Für einen axiomatischen Aufbau Thermodynamik als Teildisziplin ist der Begriff des thermischen Gleichgewichts (gleiche Temperatur) von zentraler Bedeutung. Gehen doch thermodynamische Systeme nach Vorgängen, die mit Zustandsänderungen verbunden sind, nach kurzer Zeit von selbst in einen thermischen Gleichgewichtszustand über. Das bedeutet, dass die Zustandsgrößen zeitunabhängig sind. Dieses Streben nach Temperaturausgleich wird daher heute oft als nullter Hauptsatz der Thermodynamik bezeichnet.
Die Temperatur wird auch nach einer Trennung der Systeme beibehalten, wenn keine Wärmeübertragung zwischen Systemen und Umgebung erfolgt.
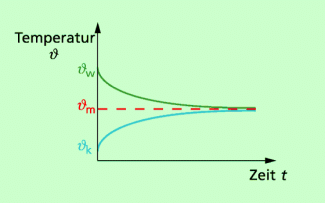
In Bild 1 ist der typische Verlauf der Temperaturen für zwei Körper dargestellt, die sich in engem Kontakt befinden. Während sich der kältere Körper erwärmt, verringert der wärmere Körper seine Temperatur solange, bis beide Körper die gleiche Temperatur haben.
Diese Eigenschaft thermodynamischer Systeme ist Grundlage für viele Temperaturmessungen. Dabei ist der eine Körper derjenige, dessen Temperatur gemessen werden soll und der andere ist das Thermometergefäß oder der Temperatursensor.
Für den Temperaturausgleich zwischen Thermometer und Körper ist eine bestimmte Zeit erforderlich. Erst nach dem Einstellen des thermischen Gleichgewichts sollte die Temperatur gemessen werden, da sonst ein größerer Messfehler entsteht.
Bei modernen Thermometern wird der Temperatursensor so klein gebaut, dass der Temperaturausgleich sehr schnell erfolgt und man bereits nach kurzer Zeit den richtigen Wert für die Temperatur ablesen kann. Das wird z. B. bei modernen Fieberthermometern genutzt.
Nicht immer ist allerdings eine Temperaturmessung durch einen direkten Kontakt zwischen Körper und Thermometer möglich. Für die Messung von sehr hohen Temperaturen, wie sie bei glühender Lava eines Vulkanausbruchs oder in der Schmelze von Metallen auftreten, müssen andere Verfahren verwendet werden, weil bei einem direkten Kontakt das Thermometer zerstört werden würde. In solchen Fällen kann man z.B. spektroskopische Eigenschaften nutzen.
-
Temperatur-Zeit-Diagramm für den Temperaturausgleich zweier Körper