Gesetz von Amontons
Unter der Bedingung, dass das Volumen eines Gases konstant ist und sich das Gas wie das ideale Gas verhält, gilt:
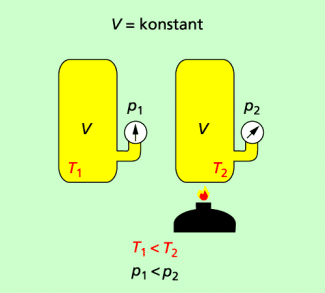
Je höher die Temperatur eines Gases ist, desto größer ist der Druck in ihm.
Das Gesetz wurde erstmals von dem französischen Naturwissenschaftler GUILLAUME AMONTONS (1663-1705) formuliert.
In einer abgeschlossenen Gasmenge, z. B. in einer Gasflasche mit Sauerstoff oder in einem PKW-Reifen mit Luft, herrscht bei einer bestimmten Temperatur ein bestimmter Druck. Das Volumen der Gasmenge wird durch das Volumen des Gefäßes bestimmt und ist konstant. Wenn sich die Temperatur des Gases ändert, dann ändert sich auch der Druck im Gas.
Je höher die Temperatur ist, desto größer ist der Druck im Gas. Unter der Bedingung, dass das Volumen eines Gases konstant ist und sich das Gas wie das ideale Gas verhält, gilt:
Das Gesetz wurde erstmals von dem französischen Naturwissenschaftler GUILLAUME AMONTONS (1663-1705) formuliert und wird heute als Gesetz von AMONTONS oder als Druck-Temperatur-Gesetz bezeichnet. Dieses Gesetz ist ein Spezialfall der Zustandsgleichung für das ideale Gas. Da bei dem betrachteten Vorgang das Volumen des Gases konstant bleibt, sich aber bei Erwärmung Temperatur und Druck ändern, spricht man in der Physik auch von einer isochoren Zustandsänderung des Gases.
Beispiele für das Wirken des Gesetzes
Beispiele für das Wirken des Gesetzes von AMONTONS sind Gasflaschen, Spraydosen oder PKW-Reifen, in denen sich eine abgeschlossene Menge eines Gases befindet, das sich näherungsweise wie das ideale Gas verhält. Erhöht sich z. B. durch Sonneneinstrahlung oder durch andere Einwirkungen die Temperatur, so erhöht sich auch der Druck im Gas.
-
Bei konstantem Volumen gilt: Je höher die Temperatur, desto größer der Druck.
Bei Gasflaschen und Spraydosen darf die Temperatur bestimmte Werte nicht übersteigen, weil sonst wegen der Erhöhung des Druckes mit der Temperatur Explosionsgefahr besteht. So sollte bei Spraydosen auf keinen Fall eine Temperatur von 50 °C überschritten werden. Wegen der Explosionsgefahr ist das lebensgefährlich.
Autoreifen dehnen sich aufgrund ihres Aufbaus kaum aus. Damit erhöht sich auch in ihnen mit steigender Temperatur der Druck. Eine Temperaturerhöhung und damit einer Druckerhöhung tritt nicht nur auf, wenn ein Fahrzeug in der prallen Sonne steht, sondern auch beim schnellen Fahren. Deshalb ist es nicht zweckmäßig, nach längeren Fahrten den Luftdruck zu kontrollieren. Die für Reifen empfohlenen Druckwerte beziehen sich immer auf den Reifendruck bei Umgebungstemperatur.
-
Spraydosen: Vor Temperaturen über 50 °C schützen!

L. Meyer, Potsdam

