Grundgleichung der Wärmelehre
Unter der Bedingung, dass keine Änderung des Aggregatzustandes erfolgt, gilt für die einem Körper zugeführte oder von ihm abgegebene Wärme:
Führt man einem Körper Wärme zu, so erhöht sich i. Allg. seine Temperatur. Gibt ein Körper Wärme ab, so verringert sich seine Temperatur. Um wie viel Grad sich die Temperatur eines Körpers bei bestimmter Wärmezufuhr bzw. Wärmeabgabe verändert, hängt auch von dem Stoff ab, aus dem er besteht.
Der Zusammenhang zwischen der Temperaturänderung eines Körpers und der von ihm aufgenommenen bzw. abgegebenen Wärme ist in der Grundgleichung der Wärmelehre (auch: Grundgleichung der Thermodynamik oder Gleichung für die Wärme) erfasst. Sie lautet:
Unter der Bedingung, dass keine Änderung des Aggregatzustandes erfolgt, gilt für die einem Körper zugeführte oder von ihm abgegebene Wärme:
Die Gleichung ist nicht anwendbar, wenn bei dem betrachteten Stoff eine Aggregatzustandsänderung vor sich geht. In diesem Falle muss auch noch die jeweilige Umwandlungswärme berücksichtigt werden.
Interpretation der Grundgleichung und Beispiele
Nachfolgend ist eine Interpretation der Grundgleichung gegeben und es sind jeweils Beispiele für die Anwendung genannt.
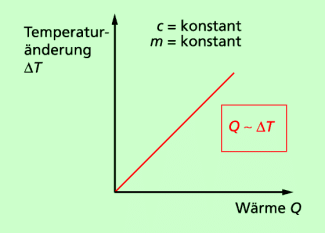
(1) Für einen bestimmten Stoff (c = konstant) mit bestimmter Masse (m = konstant) gilt:
Das bedeutet: Die Temperaturänderung ist umso größer, je größer die zugeführte bzw. abgegebene Wärme ist.
Beispiel: Je länger ein Liter Wasser auf einer Herdplatte steht, desto höher ist die Temperatur, die erreicht wird. Dabei wird natürlich vorausgesetzt, dass die Temperaturen unterhalb der Siedetemperatur liegen.
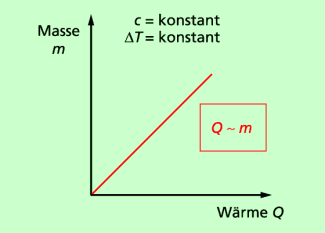
(2) Für einen bestimmten Stoff (c = konstant) und eine bestimmte Temperaturänderung gilt:
Das bedeutet: Die einem Körper zugeführte oder von ihm abgegebene Wärme ist umso größer, je größer die Masse des Körpers ist.
Beispiel: Wenn sich Wasser in einem See abkühlt, dann wird wesentlich mehr Wärme frei als beim Abkühlen von 1 l Wasser um die gleiche Temperaturdifferenz.
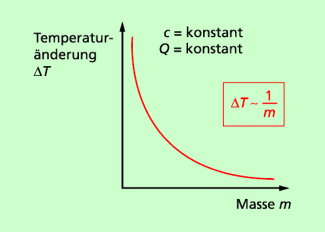
(3) Für einen bestimmten Stoff (c = konstant) und eine bestimmte Wärme (Q = konstant) gilt:
Das bedeutet: Die Temperaturänderung ist für einen Stoff umso größer, je kleiner seine Masse ist.
Beispiel: Wenn 1 Liter Wasser und 0,5 Liter Wasser die gleiche Wärme zugeführt werden, dann erwärmen sich 0,5 Liter Wasser stärker (doppelt so stark) wie 1 Liter Wasser.