Massenwirkungsgesetz
Bei reversiblen chemischen Reaktionssystemen stellt sich ein Gleichgewicht zwischen Hin- und Rückreaktion ein. Solche Reaktionen verlaufen nicht vollständig, d. h. die Konzentration der Ausgangsstoffe sinkt nicht auf null. In Abhängigkeit von den Reaktionsbedingungen (Druck, Temperatur) werden konstante Gleichgewichtskonzentrationen der an der Reaktion beteiligten Stoffe erreicht. Mit Hilfe des Massenwirkungsgesetzes können diese in Form der Gleichgewichtskonstanten berechnet werden.
Chemische Reaktionen laufen nie vollständig ab, sondern sie erreichen einen Gleichgewichtszustand. Dieser Zustand ist dadurch gekennzeichnet, dass in einer bestimmten Zeiteinheit ebenso viele Produktmoleküle zu den Ausgangsstoffen reagieren, wie Produktmoleküle aus den Ausgangsstoffen gebildet werden. Folglich ändert sich die Konzentrationen der an der Reaktion beteiligten Stoffe nicht mehr, d. h. die Konzentrationen bleiben konstant.
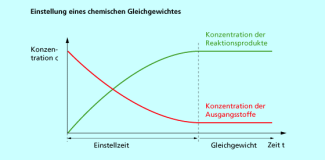
Es dauert jedoch eine gewisse, von Reaktion zu Reaktion unterschiedliche Zeit, bis sich diese Gleichgewichtskonzentrationen eingestellt haben. Die Zeitspanne bis zum Erreichen der konstanten Konzentrationen nennt man Einstellzeit des chemischen Gleichgewichts (Bild 2).
Betrachtet man das Reaktionsgemisch als Ganzes, so erfolgen keine Veränderungen mehr, während bei einer Betrachtung einzelner Moleküle Veränderungen zu beobachten sind. Die Anzahl der in der Hin- und Rückreaktion umgesetzten Moleküle ist jedoch identisch, d. h. die Geschwindigkeit von Hin- und Rückreaktion sind gleich. Einen solchen Zustand bezeichnet man als dynamisch.
Das chemische Gleichgewicht stellt sich bei umkehrbaren (reversiblen) Reaktionen ein und wird in der Reaktionsgleichung durch einen Gleichgewichtspfeil charakterisiert.
Mathematisch läßt sich das chemische Gleichgewicht durch das Massenwirkungsgesetz beschreiben, das 1867 vom norwegischen Technologen und Mathematiker CATO MAXIMILIAN GULDBERG (1836-1902) und dem norwegischen Chemiker PETER WAAGE (1833-1900) hergeleitet wurde.
Definition
Bei gegebener Temperatur und Druck ist der Quotient aus dem Produkt der Konzentrationen der Reaktionsprodukte und dem Produkt der Konzentrationen der Ausgangsstoffe eine Konstante die Gleichgewichtskonstante K.
Für die oben genannte allgemeine Beispielreaktion lautet des Massenwirkungsgesetz:
-
Einstellung eines chemischen Gleichgewichts
Das Gleichgewicht der reversiblen Reaktion liegt auf der Seite des Reaktionsprodukts (AB), wenn die Gleichgewichtskonstante K >>1 ist.
Ist die Gleichgewichtskonstante K <<1, liegt das Gleichgewicht auf Seiten der Ausgangsstoffe (A und B)
Das Massenwirkungsgesetz bezieht sich immer auf eine konkrete Reaktionsgleichung. Vereinbarungsgemäß stehen auf der linken Seite - vor dem Reaktionspfeil - die Ausgangsstoffe (Edukte) und auf der rechten Seite - nach dem Reaktionspfeil- der Reaktionsgleichung die Endstoffe (Produkte).
Beispiel
Ein Beispiel für eine reversible Reaktion, bei der sich ein chemisches Gleichgewicht einstellt, ist die Veresterung eines Alkohols mit einer Säure, z. B. die Reaktion zwischen Ethanol und Essigsäure.
![]()
Die chemischen Reaktionen zur Esterbildung und Esterspaltung laufen gleichzeitig ab. Es stellt sich ein chemisches Gleichgewicht ein.
Werden Ethanol und Essigsäure in einem geschlossenen Gefäß im Stoffmengenverhältnis 1 mol : 1 mol gemischt (mit Schwefelsäure als Katalysator versetzt) reagieren nur 0,67 mol der Ausgangsstoffe zu Ester und Wasser. 0,33 mol der Ausgangsstoffe bleiben unverändert.
Im Gleichgewicht liegen dann 0,67 mol Ester, 0,67 mol Wasser, 0,33 mol Alkohol und 0,33 mol Säure vor. Das gleiche Ergebnis wird erhalten, wenn man 1 mol Ester mit 1 mol Wasser umsetzt.
Setzt man die Gleichgewichtskonzentrationen in das MWG ein, so ergibt sich eine Gleichgewichtskonstante von K = 4. Diese ist bei gegebenem Druck und Temperatur unveränderlich.
Die Abhängigkeit chemischer Gleichgewichte von den äußeren Bedingungen beschreibt das vom französichen Chemiker HENRY LOUIS LE CHATELIER formulierte Prinzip vom kleinsten Zwang . Danach versucht ein chemisches System einem äußeren durch die Änderung von Druck oder Temperatur verursachten Zwang auszuweichen. Dadurch ändert sich das Verhältnis der Konzentrationen der Ausgangsstoffe und Reaktionsprodukte und somit die Gleichgewichtskonstante K.
Katalysatoren haben keinen Einfluß auf die Gleichgewichtslage und damit auch nicht auf den Wert der Gleichgewichtskonstante. Die Formel des Massenwirkungsgesetztes bleibt unverändert. Katalysatoren bewirken nur eine Veränderung der Reaktionsgeschwindigkeit der Hin- und Rückreaktion, d. h. sie verringern die Einstellzeit des chemischen Gleichgewichts.

