Reaktionen von Stoffen mit Wasser
Wasser ist einer der wichtigsten Stoffe auf der Erde. Es dient nicht nur als Nahrungs- und Transportmittel, sondern ist ein bedeutender Reaktionspartner und verbreitet genutztes Lösungsmittel in der Chemie, Biologie und der Technik. Die außergewöhnlichen Eigenschaften des Wassers lassen sich mit seinen Bindungs- und Strukturverhältnissen erklären. Auf welche Weise Wasser mit anderen Partnern reagiert, hängt jedoch hauptsächlich von den Bindungseigenschaften des jeweiligen Stoffs ab. Man unterscheidet folgende Reaktionen:
- Hydratation,
- Protolyse,
- Hydrolyse,
- Redoxreaktionen mit Wasser,
- Komplexbildung,
- Hydratisierung.
Wasser ist die Quelle des Lebens auf der Erde. Zur Energiegewinnung, zur Aufrechterhaltung der Lebensprozesse, als Klimafaktor, Transportmittel, als Rohstoffquelle und Reaktionspartner ist diese Verbindung unersetzlich.
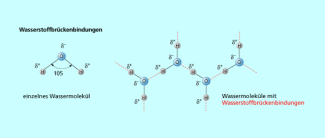
Die Zusammensetzung, Wasserstoffoxid, wurde erstmals von HENRY CAVENDISH (1731-1810) erkannt. Das Wassermolekül ist gewinkelt. Die unterschiedlichen Elektronegativitäten von Sauerstoff und Wasserstoff führen zu polaren O-H-Bindungen, sodass das Wassermolekül ein Dipol ist. Diese Dipole werden über Wasserstoffbrückenbindungen zu großen Aggregaten zusammengehalten, was zu außergewöhnlichen Eigenschaften des Wassers führt:
| – | Es hat im Vergleich zu verwandten binären Element-Wasserstoff-Verbindungen wie Methan oder Ammoniak einen hohen Schmelz- und Siedepunkt. |
| – | Die größte Dichte hat Wasser bei +4 °C. Unterhalb dieser Temperatur nimmt die Dichte wieder ab (Anomalie des Wassers), da sich auch schon im flüssigen Aggregatzustand weniger dicht gepackte Strukturen bilden. |
| – | Eis hat eine um 10 % geringere Dichte als Wasser bei 0 °C und schwimmt auf der Wasseroberfläche (Eisberge). |
| – | Wasser ist ein gutes Lösungsmittel für ionische und kovalente Verbindungen. |
| – | Wasser besitzt eine hohe Verdampfungswärme |
-
Dipolcharakter des Wassermoleküls und Ausbildung von Wasserstoffbrücken
Hydratation/Dehydratation
Wasser ist ein gutes Lösungsmittel für ionische Substanzen. Beim Lösen muss die mitunter hohe Gitterenergie der Salze überwunden werden. Das erfolgt durch Bildung von Hydraten in der wässrigen Lösung. Die Hydratationsenergie wird frei.
In grober Näherung lässt sich aussagen, dass eine ionische Substanz dann in Wasser löslich ist, wenn die Hydratationsenergie höher als seine Gitterenergie ist.
Die Hydratation ist ein Spezialfall der Solvatation, also auf das Lösungsmittel, das Solvens, Wasser bezogen. Besonders kleine Kationen (H+, Li+, Mg2+) und kleine Anionen (F-, OH-) lagern Wasserdipole um sich, weil die von ihnen ausgehende elektrostatische Wechselwirkung besonders groß ist. Das führt auch dazu, dass sich nicht nur eine Wasserschicht um das zentrale Kation oder Anion anlagert, sondern dass mehrere Schichten Wasser um solche Ionen ausgebildet und durch zusätzliche Wasserstoffbrückenbindungen zusammengehalten werden.
So ist das in Wasser hydratisierte Lithium-Ion so groß, dass es sich beim Anlegen einer äußeren Spannung, z. B. bei der Elektrolyse, infolge der großen Hydrathülle nur sehr langsam im Lösungsmittel Wasser bewegen kann. Durch die Wasserhülle werden die Nucleophilie der Anionen und die Elektrophilie der Kationen herabgesetzt.
In der Regel ist die Anzahl der Wasserteilchen in der Hydrathülle kaum zu bestimmen. Einige Salze bilden jedoch definierte Hydrate mit einer ganz bestimmten Hydratationszahl x .
Das Wasser kann nicht nur beim Lösen, sondern auch aus der Luft aufgenommen werden, sodass solche Substanzen, die stabile Hydrate bilden, als Trockenmittel in Labor und Technik eingesetzt werden (z. B. wasserfreies MgSO4 oder CaCl2).
Die Rückreaktion, d. h. das Entfernen von Hydratwasser wird als Entwässern oder Dehydratisierung bezeichnet. Auch hierbei spielt die Ionengröße wieder eine große Rolle.
Protolyse
Auch nach intensiver Reinigung des Wassers, z. B. durch mehrfache Destillation in absolut sauberen Platinapparaturen, wird eine geringe Leitfähigkeit gemessen, die auf die Dissoziation des Wassers selbst zurückzuführen ist. Aufgrund der Eigendissoziation sind in 10 000 t Wasser ca. 1 mol Hydroxid-Ionen, OH--Ionen und 2 mol hydratisierte H+-Ionen vorhanden.
Da von den bei der Dissoziation einer OH-Bindung entstehenden ein sehr starkes elektrostatisches Feld ausgeht, lagern sich diese an an. Das führt zu Oxonium-Ionen, oder meist zu weiteren Aggregationen wie in denen ein von -Molekülen tetraedrisch umgeben ist.
Entsprechend der oben stehenden Reaktionsgleichung ist Wasser also ein Ampholyt, der je nach Reaktionspartner als Brönsted-Säure oder Brönsted-Base reagieren kann.
Ammoniak reagiert in Wasser basisch, da es ein Proton vom Wassermolekül aufnimmt. Chlorwasserstoff reagiert dagegen in Wasser sauer, da das HCl-Molekül sein Proton an das Wassermolekül abgibt.
Diese Protonenaustauschreaktionen werden als Protolyse bezeichnet.
Auch beim Auflösen von Salzen in Wasser sind solche Protolysereaktionen zu beobachten. Eine wässrige Lösung von Natriumcarbonat reagiert in Wasser alkalisch, weil die bei der Dissoziation des Salzes entstehenden Carbonat-Ionen als Protonenakzeptoren mit Wasser reagieren.
Wird Ammoniumchlorid in Wasser gelöst, so reagiert die Lösung schwach sauer, weil die bei der Dissoziation gebildeten Ammonium-Ionen mit Wasser als Protonendonatoren reagieren.
Hydrolyse
Hydratation und Protolyse finden hauptsächlich mit ionischen Verbindungen oder stark polaren Molekülverbindungen statt. An polare Atombindungen kann der Dipol Wasser aber auch angreifen, ohne dass Protonen übertragen werden.
So lagert sich das Wassermolekül an die polare B-Cl-Bindung im Bortrichlorid so an, dass das O-Donatoratom am Boratom und ein H-Akzeptoratom am Chloratom in Wechselwirkung treten. Es kommt zur Abspaltung von Chlorwasserstoff und zur Ausbildung einer B-OH-Bindung. Diese Spaltung kovalenter Bindungen durch Wasser unter Ausbildung neuer Molekülverbindungen nennt man Hydrolyse.
So werden viele kovalente Halogenverbindungen durch Wasser hydrolytisch gespalten, wobei die Reaktion stufenweise abläuft und die Zwischenprodukte auch isoliert werden können.
Die Hydrolyse beruht auf der Polarität von polaren Atombindungen infolge der unterschiedlichen Elektronegativität der Atome. Im Wassermolekül ist das Sauerstoffatom partiell negativ geladen und tritt immer mit dem elektropositiveren Atom des Partners in Wechselwirkung. Das Wasserstoffatom lagert sich immer an das Atom, das die negative Partialladung trägt.
Die direkten Reaktionsprodukte der Hydrolyse sind fast immer Molekülverbindungen. Häufig können diese in Folgereaktionen protolysieren (z. B. HCl) und die dabei entstehenden Ionen auch solvatisiert werden.
Wasser als Oxidations- und Reduktionsmittel
Wasser enthält die Bestandteile Wasserstoff und Sauerstoff in verschiedenen Oxidationsstufen. Die Sauerstoffatome mit der Oxidationsstufe -II können von einem geeigneten Reaktionspartner oxidiert werden und würden dann z. B. in elementaren Sauerstoff überführt. Ein Reaktionsbeispiel ist die Reduktion von Cobalt(III)-Ionen in wässriger Lösung zu Cobalt(II)-Ionen:
Solche Redoxreaktionen geht Wasser nur mit sehr starken Oxidationsmitteln ein. Mit geeigneten Reduktionsmitteln dagegen können die Wasserstoffatome mit der Oxidationsstufe +I in Wasserstoff überführt werden. Das passiert z. B. bei der Umsetzung von Calciumhydrid mit Wasser:
Die Reaktion von Hydriden mit Wasser ist die einzige Redoxreaktion, die gleichzeitig eine Hydrolyse ist. Im Normalfall ändern sich bei der Hydrolyse die Oxidationszahlen der Atome nicht.
Bei hohen Temperaturen geht gasförmiges Wasser noch weitere Redoxreaktionen ein, z. B. bei der Vergasung von Kohle:
Wasser als Komplexbildner
Nebengruppenelemente bilden Verbindungen mit Wasser. Hier wird das Wasser als ein Ligand betrachtet, der über die freien Elektronenpaare des Wassermoleküls (Elektronenpaardonator) mit den leeren d-Niveaus der Nebengruppenelemente (Elektronenpaarakzeptor) in Wechselwirkung tritt.
Durch die Elektronenpaare des Wassers erreichen die Metall-Ionen eine stabile Valenzelektronenkonfiguration mit 18 Elektronen. Davon hängt die Anzahl der in aquo-Komplexen gebundenen Wassermoleküle, also die Koordinationszahl ab. Oft beträgt die Koordinationszahl 4, wie z. B. im Tetraaquokupfer(II)-Ion, oder 6 wie im Hexaaquoeisen(II)-Ion,
Hydratisierung/Dehydratisierung
Wird Wasser an organische Verbindungen unter Spaltung der H-O-Bindung angelagert, so spricht man von Hydratisierung. In Gegenwart starker Säuren lässt sich Wasser z. B. an Ethen anlagern, wobei Ethanol gebildet wird:
Wasser läßt sich auch nucleophil an Alkine anlagern. Bei dieser Reaktion bildet sich aus Ethin Vinylalkohol, der säurekatalysiert in Ethanal umgewandelt wird. Aus anderen Alkinen werden bei der Hydratisierung Ketone gebildet.
Die Begriffe Hydratisierung und Dehydratisierung sind nicht mit denen der Hydrierung und Dehydrierung (Dehydrogenierung) zu verwechseln. Darunter werden in der Chemie die Einführung von Wasserstoff z. B. an Mehrfachbindungen und die entsprechende Abspaltung verstanden.
Zusammenfassend betrachtet werden die einzelnen Reaktionen von Stoffen mit Wasser in Bild 8.

