Andere einwertige Alkohole – Eigenschaften und Verwendung
In diesem Artikel werden die Eigenschaften und Verwendungszwecke unterschiedlicher einwertiger Alkohole (außer Methanol und Ethanol) beschrieben. Ab dem Propanol können erste Konstitutionsisomere auftreten. Bis zum Hexanol werden derartige Isomere dargestellt.
Schon an diesen wenigen Beispielen sind grundsätzliche Gemeinsamkeiten, aber auch wesentliche Unterschiede in Eigenschaften und Verwendung erkennbar.
Außerdem lassen sich Kenntnisse über homologe Reihen anwenden. An dem Beispiel der Alkanole mit endständiger Hydroxylgruppe wird darauf genauer eingegangen.
Einwertige Alkohole
Zu den einwertigen Alkoholen gehören kettenförmige und cyclische (alicyclische) organische Verbindungen mit einer Hydroxylgruppe im Molekül. (Aufgrund ihrer besonderen chemischen Reaktionen werden die Phenole im Allgemeinen nicht zu den Alkoholen gezählt.)
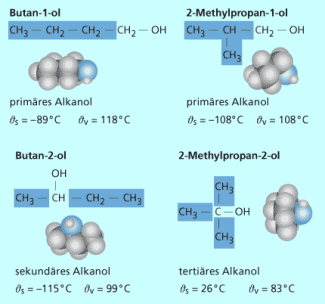
Bei den einwertigen Alkoholen existieren ab dem Propanol Isomere , die die gleiche Summenformel aufweisen, sich aber durch die Stellung der Hydroxylgruppe im Molekül unterscheiden. Die Namensgebung hängt mit der Lage der funktionellen Gruppe zusammen. So sitzt bei primären Alkoholen die Hydroxylgruppe endständig und wird durch eine 1 im Namen gekennzeichnet, z. B. Hexan-1-ol. Bei sekundären Alkoholen liegt eine mittelständige Hydroxylgruppe vor (einfachster Vertreter: Propan-2-ol) und bei tertiären Alkoholen befindet sich die Hydroxylgruppe an der Verzweigungsstelle einer Kohlenstoffkette (z. B. 2-Methylpropan-2-ol).
Die Eigenschaften der Alkohole werden durch die Hydroxylgruppe, mit steigender Kettenlänge aber auch in zunehmendem Maße durch den bzw. die Molekülreste bestimmt. Die Tendenz der Eigenschaftsänderungen erfolgt in charakteristischer Weise. Im Allgemeinen ändern sich die meisten Eigenschaften immer weniger, je länger die Kohlenstoffkette wird. So kann man bei den Alkoholen beispielsweise ab den Hexanolen Verallgemeinerungen treffen, die sowohl für die meisten Hexanole als auch für die folgenden Alkohole, wie die Heptanole, Octanole usw. zutreffen.
Bei den folgenden Beispielen werden Alkanole , also einwertige Akohole, die sich von den Alkanen ableiten, betrachtet.
Propanole
Bei den Propanole n gibt es zwei mögliche Strukturen:
Propan-1-ol (Propylalkohol) und Propan-2-ol (Isopropylalkohol).
![]()
Es sind farblose, mit Wasser, Ethanol und Ether mischbare, brennbare Flüssigkeiten, die bei der Reaktion mit Alkalimetallen wie Natrium unter Abgabe des Wasserstoffatoms der Hydroxylgruppe die Propanolate bilden.
Stoffdaten:
| Stoff | Schmelz-temperatur (°C) | Siede-temperatur (°C) | Dichte, 25 °C (g/cm3) | Gewinnung |
| Propan-1-ol | -126 | 97,2 | 0,799 | u. a. durch katalytische Oxidation von Propan |
| Propan-2-ol (Isopropanol) | -88 | 82,3 | 0,781 | katalytische Addition von Wasser an Propen |
Die physiologische Wirkung beider Alkohole ist ähnlich der von Ethanol mit Betäubung und Atemlähmung bei hohen Konzentrationen.
Die größere technische Bedeutung hat Propan-2-ol. Es wird z. B. als Lösungs- und Frostschutzmittel verwendet. Durch katalytische Dehydrierung gewinnt man daraus Aceton.
Butanole
Bei den Butanolen gibt es vier mögliche Strukturen:
Butan-1-ol (primärer Butylalkohol),
![]()
2-Methylpropan-1-ol (Isobutylalkohol, primärer Alkohol),
![]()
Butan-2-ol (sekundärer Butylalkohol)
![]()
und 2-Methylpropan-2-ol (tertiärer Butylalkohol).
![]()
Es existieren also vier mögliche Isomere: zwei primäre und je ein sekundärer sowie ein tertiärer Alkohol. In Wasser sind sie mäßig, in vielen organischen Lösungsmitteln gut löslich. Dies ist durch die steigende Kettenlänge und den dadurch zunehmenden lipophilen (fettfreundlichen) Charakter der höheren Alkohole begründet. Ob als Flüssigkeiten oder Dämpfe, die Butanole reizen sowohl Augen und Atemwege, als auch die Haut und Mundschleimhaut. In höheren Konzentrationen wirken vor allem die Dämpfe narkotisch. Der MAK-Wert (Maximale Arbeitsplatz-Konzentration) beträgt 100 ppm.
| Stoff | Dichte in | Schmelztemperatur | Siedetemperatur |
|---|---|---|---|
| Butan-1-ol | 0,813 | -90 °C | 118 °C |
| 2-Methylpropan-1-ol | 0,806 | -108 °C | 108 °C |
| Butan-2-ol | 0,811 | -115 °C | 100 °C |
| 2-Methylpropan-2-ol | 0,776 | 25,6 °C | 82,5°C |
Die primären Alkohole Butyl- und Isobutylalkohol werden in erster Linie zur Herstellung von Lösungsmitteln, Ethern, Estern und Lacken verwendet. Die Ether und Ester sind wichtige Bestandteile der Parfümindustrie (ebenfalls in der Aromen- und Riechstoffindustrie), wo sie vor allem als Lösungsmittel, Duftstoffe und Weichmacher dienen.
Das Butan-2-ol ist der wichtigste Ausgangsstoff bei der Produktion von Butan-2-on. Er findet zusätzlich Einsatz in Mischlösungsmitteln, Abbeizmitteln, Bremsflüssigkeiten und ebenfalls in begrenzten Mengen in der Parfümindustrie.
Der tertiäre Butylalkohol dient als Treibstoffzusatz und Lösungsmittel.
Pentanole
Bei den Pentanolen (auch als Amylalkohole bekannt) gibt es acht mögliche Strukturen, die sich grob in die Methylbutanole (vier Isomere), „Pentanole“ (drei) und Dimethylpropanol (nur eine Möglichkeit) untergliedern lassen:
Pentan-1-ol: farblose, brennbare, klare Flüssigkeit, Schmelztemperatur -79 °C, Siedetemperatur 138 °C; Lösungsmittel, Rohstoff in der Pharmaindustrie
Pentan-2-ol : farblose, brennbare, klare Flüssigkeit, Schmelztemperatur -50 °C, Siedetemperatur 119 °C; Lösungsmittel (in Farben und Lacken)
Pentan-3-ol : brennbare, farblose Flüssigkeit, Schmelztemperatur
-8 °C, Siedetemperatur 116 °C; Lösungsmittel
Methylbutanole: (Sammelname der einfach verzweigten Pentanole)
3-Methylbutan-1-ol, 3-Methylbutan-2-ol, 2-Methylbutan-2-ol und
2-Methylbutan-1-ol sind Flüssigkeiten.
2,2-Dimethylpropan-1-ol: Schmelztemperatur 53 °C, Siedetemperatur 114 °C
Im Gegensatz zu Propanol und Butanol lösen sie sich zunehmend schlechter in Wasser, dafür besser in organischen Lösungsmitteln.
Pentanole werden als Nebenprodukte bei der alkoholischen Gärung gebildet (sogenannte Fuselöle). Da sie unter anderem starke Kopfschmerzen verursachen, müssen sie beim „Brennen“, also bei der destillativen Aufkonzentrierung des Alkohols, abgetrennt werden.
-
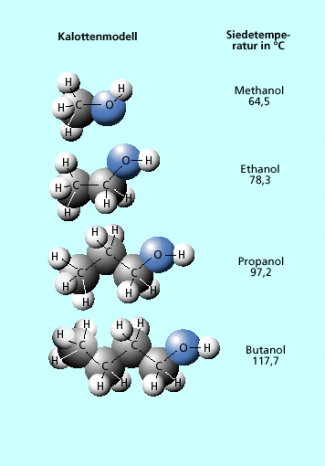
Homologe Reihe der Alkanole
-
Isomerie organischer Verbindungen
Die homologe Reihe der Alkanole
Viele der nachfolgenden genannten Eigenschaften lassen sich zwar auf viele Alkohole mit aufsteigender Kohlenstoffatomanzahl anwenden, jedoch nicht auf alle. Will man allgemein gültige Aussagen treffen, darf man deshalb genaugenommen nur die Alkohole betrachten, die gleiche Strukturmerkmale aufweisen, also beispielsweise kettenförmige, unverzweigte und gesättigte Alkohole, die die Hydroxylgruppe an einem endständigen Kohlenstoffatom besitzen. Dabei handelt es sich um ein besondere Gruppe innerhalb der Alkanole. Für diese homologe Reihe der Alkanole gelten die folgenden Verallgemeinerungen ohne Ausnahme.
Allgemeine Summenformel:
Löslichkeit in Wasser: nimmt mit Zunahme der Kettenlänge ab
Löslichkeit in organischen Lösungsmitteln: nimmt mit der Kettenlänge zu
Schmelztemperatur: steigt; bis zu hohen Kohlenstoffatomzahlen flüssig
Siedetemperatur: steigt ebenfalls mit zunehmender Kettenlänge an
Aggregatzustand: bis zum einschließlich 12. Alkanol der homologen Reihe Flüssigkeiten, die mit zunehmender Kettenlänge einen „fettigen“ Charakter annehmen, ab dem 13. Alkanol liegen kristallartige Feststoffe vor
Giftigkeit: Alle giftig! Ethanol verträgt der Körper in verdünnten Lösungen und bei geringen Mengen jedoch recht gut. Die Alkanole können sowohl als Flüssigkeiten als auch als Dämpfe aufgenommen werden. Besonders gefährdet sind die Augen.
Die chemischen Eigenschaften werden durch die Hydroxylgruppe und den Alkylrest bestimmt. Alkanole können oxidiert werden. Aufgrund der endständigen Hydroxylgruppe entstehen bei der Oxidation im ersten Schritt Alkanale, dann Alkansäuren.
Typisch ist für die Alkanole ihre Reaktion mit Alkalimetallen , bei denen Alkanolate und Wasserstoff gebildet werden. Im interaktiven Diagramm sind die unterschiedlichen Reaktionszeiten verschiedener Alkanole mit der gleichen Masse an Natrium dargestellt.
Alkanole reagieren mit der Carboxylgruppe von Carbonsäuren unter Abspaltung von Wasser reagieren zu Carbonsäureestern.
Auch wenn das typische chemische Eigenschaften aller Glieder der homologen Reihe sind, gibt es infolge der zunehmenden Kettenlänge auch hier Abstufungen:
Alkoholischer Charakter: nimmt ab, da mit zunehmender Kettenlänge der Einfluss der Hydroxylgruppe geringer wird
Brennbarkeit: alle brennbar
Entzündbarkeit: nimmt ab, da der Verdampfungsdruck abnimmt
Flamme: bei Methanol schwach blau, später zunehmend gelber und leicht bis mittelstark rußend, allerdings nicht so stark wie bei Alkenen und Alkinen.
Suche nach passenden Schlagwörtern
- Siedetemperatur
- Eigenschaftsveränderungen
- Butanole
- Brennbarkeit
- einwertig
- Alkanole
- Propanole
- Alkohol
- Isopropanol
- Pentanole
- Aceton
- Isomere
- Hexanole
- Schmelztemperatur
- lipophil
- Hydroxylgruppe
- Insektenabwehrmittel
- Parfümindustrie
- Frostschutzmittel
- Simulation
- Rechenbeispiel
- homologe Reihe
- Animation
- MAK-Wert

