Synthesegas für die Ammoniakherstellung
Für die Ammoniaksynthese benötigt man Stickstoff und Wasserstoff im Verhältnis 1 : 3. Dieses Gasgemisch kann auf unterschiedliche Arten erhalten werden. Von den verschiedenen Möglichkeiten, Stickstoff und Wasserstoff zu gewinnen, hat sich besonders das sogenannte Steamreforming durchgesetzt, weil es relativ preiswert ist. Hierbei wird das Synthesegas aus Erdgas (Methan), Wasserdampf und Luft hergestellt.
Für die Ammoniakherstellung benötigt man Stickstoff und Wasserstoff im Verhältnis 1 : 3.
Im Prinzip wäre es möglich, Stickstoff aus der Luft durch Tieftemperaturdestillation (analog der Gewinnung des Stickstoffs zum Abfüllen von Stahlflaschen) und Wasserstoff durch Elektrolyse von Wasser zu gewinnen. Dieser Weg ist aber für die großtechnische Verwendung viel zu teuer.
Stickstoff wird aus Luft gewonnen. Dazu wurde früher der darin enthaltene Sauerstoff z. B. mit Kohlenstoff zu Kohlenstoffdioxid umgesetzt. Nach Abtrennen des , das mit Wasser ausgewaschen werden kann, bleibt Stickstoff zurück.
Wasserstoff wurde anfangs aus Kohle und Wasser gewonnen, was kostengünstiger ist als die Elektrolyse von Wasser.
Nach Umwandlung (Konvertierung) von kann letzteres wieder durch Waschen abgetrennt werden.
Steamreforming
Wesentlich günstiger ist es, anstelle von Kohle oder Erdölfraktionen dafür Erdgas (Methan) einzusetzen, da durch die Mitnutzung des Wasserstoffanteils aus Methan Wasserstoff viel effektiver bereitgestellt werden kann. Daher wird im überwiegenden Fall das Synthesegas für die Ammoniaksynthese aus Erdgas (Methan), Wasserdampf und Luft hergestellt.
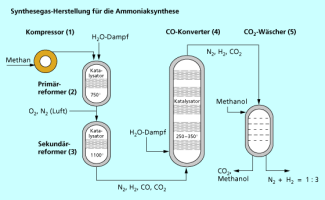
Dieser Prozess - auch als Steamreforming bezeichnet - wird hier beschrieben (Bild 2).
1. Erdgas wird im Kompressor (1) komprimiert. Alle Stufen laufen bei einem Druck von 2 - 3 MPa ab.
2. Methan wird mit Wasserdampf im Primärreformer (2) an einem Nickelkatalysator bei 750°C umgesetzt.
Das Mengenverhältnis Methan : Wasserdampf ist so gewählt, dass etwa 10% des Methans nicht umgesetzt werden. Die Wärme für die endotherme Reaktion wird durch externe Beheizung des Reaktors zugeführt.
3. Im zweiten Reaktionsschritt wird Luft zugemischt. Diese reagiert mit dem noch vorhandenen Methan im Sekundärreformer (3) an einem Nickelkatalysator bei ca. 1100°C zu einem Gemisch aus Kohlenstoffmonooxid und Kohlenstoffdioxid.
4. Nach Abkühlen in einem Wärmetauscher wird Kohlenstoffmonooxid im CO-Konverter (Konvertierungsreaktor) (4) vollständig in Kohlenstoffdioxid überführt.
Die Konvertierung läuft in zwei Stufen ab, zuerst an einem Eisenoxid / Chromoxidkontakt bei 350°C, danach an einem Zinkoxid / Kupferoxidkontakt bei 250°C. Man gewinnt dabei zusätzlich Wasserstoff.
5. Kohlenstoffdioxid wird anschließend in einem Wäscher (5) entfernt. Als Waschmittel kann z. B. kaltes Methanol eingesetzt werden, worin sich besser als in Wasser löst. Beim Erwärmen wird aus Methanol wieder freigesetzt und kann beispielsweise mit Ammoniak zur Herstellung von Harnstoff (Stickstoffdünger)genutzt werden.
Ein anderes eingesetztes Waschmittel ist eine Kaliumcarbonatlösung
Im Wäscher liegt das Gleichgewicht bei tiefen Temperaturen (40 - 50°C) auf der Seite des Hydrogencarbonats, Kohlenstoffdioxid wird also absorbiert. Beim Erwärmen der Lösung im Regenerator auf etwa 100°C verschiebt sich das Gleichgewicht auf die Seite des Carbonats. Das wird ausgetrieben und die Carbonatlösung im Kreislauf in den Wäscher zurückgeführt.
Alle Teilschritte sind so aufeinander abgestimmt, dass nach dem - Wäscher ein Gasgemisch mit einem - Verhältnis von 1 : 3 anfällt, das direkt zur Ammoniaksynthese eingesetzt werden kann.
-
Schematischer Ablauf der Synthesegasherstellung