Verwendung von Ammoniak
Ammoniak dient in der chemischen Industrie als Ausgangstoff für die Synthese vieler Verbindungen. Der größte Teil des hergestellten Ammoniaks wird zu Düngemitteln weiterverarbeitet, der Rest wird in der organisch-chemischen Industrie z. B. zur Produktion von Kunststoffen und Synthesefasern eingesetzt.
Als Düngemittel kann direkt eine wässrige Lösung von Ammoniak (Ammoniakwasser) verwendet werden, meistens wird Ammoniak aber weiterverarbeitet und in Form von Ammoniumsalzen, Nitraten oder Amiden zum Düngen eingesetzt.
Ammoniak ist ein wichtiges Grundprodukt der chemischen Industrie, das als Ausgangstoff für viele chemische Synthesen dient. Die größte Menge, etwa 80 - 85 % werden zur Herstellung verschiedener Düngemittel genutzt, der Rest wird u. a. zur Produktion verschiedener organischer Zwischenprodukte sowie von Kunststoffen und Synthesefasern eingesetzt.
Stickstoffdüngemittel
In den Pflanzen werden durch Fotosynthese aus Kohlenstoffdioxid und Wasser organische Substanzen aufgebaut, dazu müssen sie mit den Wurzeln aus dem Boden auch verschiedene anorganische Ionen aufnehmen. JUSTUS VON LIEBIG erkannte im 19. Jahrhundert die Bedeutung einer ausreichenden Versorgung der Pflanzen mit gebundenem Stickstoff, Phosphor und Kalium (den sog. Makronährstoffen) für ihr Wachstum. Nach dem Minimumsprinzip müssen sie in einem bestimmten Verhältnis zueinander stehen, eine Unterversorgung mit einem Nährstoff kann nicht durch ein Überangebot der anderen ausgeglichen werden
Die Nährstoffzufuhr erfolgte früher durch organische Dünger (Stallmist, Pflanzenabfälle). Die wachsende Nachfrage nach Nahrungsmitteln konnte nur durch Steigerung der Ernteerträge gedeckt werden. Das machte aber eine zusätzliche Versorgung des Bodens mit mineralischen Düngern erforderlich. Seit etwa 1830 wurde Nitratstickstoff aus den natürlichen Lagerstätten in Chile (Chilesalpeter, enthält ca. 98% ) als Dünger verwendet. Diese Lagerstätten haben aber begrenzte Vorräte, zudem ergeben sich nach Europa lange Transportwege. Andere natürliche Lagerstätten von Stickstoffverbindungen gibt es nicht. Daher bot die technische Ammoniaksynthese die Möglichkeit, Stickstoffdüngemittel in großen Mengen technisch herzustellen.
Der Weltverbrauch an Stickstoffdünger betrug Ende des 20. Jahrhunderts etwa 80 Millionen Tonnen (bezogen auf den Stickstoffgehalt), in Deutschland etwa 1,7 Millionen Tonnen (bezogen auf den Stickstoffgehalt).
-
Wichtige Verwendungsmöglichkeiten von Ammoniak
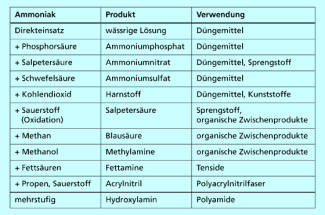
Industriell hergestellte Stickstoffdünger können den Stickstoff in ammoniakalischer Form (Ammoniak, Ammoniumsalze), in Nitratform oder in Amidform (Harnstoff, Kalkstickstoff) enthalten. Die Pflanzen können den Stickstoff sowohl in der Ammoniumform als auch in der Nitratform nutzen.
Nitrationen können von den Pflanzen unmittelbar aufgenommen werden. Sie beeinflussen daher die Stickstoffbilanz für die Pflanzen sehr schnell. Sie werden hingegen als Anionen nicht im Boden gebunden und können leicht ausgewaschen werden, wodurch bei Überdüngung das Grundwasser sehr stark mit gesundheitsschädlichem Nitrat belastet werden kann.
Ammoniumionen werden von Bodenbestandteilen (Huminstoffen) gebunden und können daher nicht so leicht ausgewaschen werden. Damit sie von den Pflanzen aufgenommen werden, müssen sie allerdings erst durch Bodenbakterien zu Nitrat-Ionen oxidiert werden. Sie wirken deshalb langsamer und nachhaltiger.
Wichtige Stickstoffdünger
Ammoniakwasser ist in einigen Ländern (z. B. USA) als Dünger sehr beliebt, da es sich als Flüssigkeit leicht ausbringen lässt und einen hohen N-Gehalt aufweist. Nachteilig sind aber die Gesundheitsschädlichkeit und die Gefahr von Verdampfungsverlusten.
Ammoniumsulfat fällt bei zahlreichen Prozessen als Nebenprodukt an (z. B. in Kokereien und bei der Rauchgasentschwefelung). Da bei seiner Anwendung im Boden Schwefelsäure frei wird, was zur Versauerung des Bodens führen kann, wird dieser Dünger heute nicht mehr so oft verwendet (Anteil etwa 5%).
-
Einige wichtige Stickstoffdüngemittel

Ammoniumnitrat ist ein konzentrierter Stickstoffdünger. Es neigt aber zu Verklumpung und kann sich unter Explosion selbst zersetzen (es dient u. a. auch als Sprengstoff). Bei der Explosion eines Ammoniumnitratlagers in der BASF wurden 1921 über 500 Menschen getötet.
In der BRD ist daher die Verwendung von reinem Ammoniumnitrat als Dünger verboten, in anderen Ländern ist es aber teilweise zugelassen.
Als Kalkammonsalpeter ist Ammoniumnitrat durch Beimischung von Kalk ungefährlich. Gleichzeitig neutralisiert der Kalk die im Boden freiwerdende Säure. Daher wird in vielen Ländern Kalkammonsalpeter eingesetzt.
Harnstoff ist der wichtigste Stickstoffdünger (Anteil über 50%). Die technische Herstellung erfolgt aus Ammoniak und Kohlenstoffdioxid unter Druck.
Er weist einen hohen Stickstoffgehalt auf und kann im Boden als Langzeitdünger wirken. Da unter Einfluss des Enzyms Urease die Hydrolyse zu Ammoniak erfolgt, wird durch Zusätze die Abbaugeschwindigkeit des Harnstoffs vermindert, indem die Aktivität der Urease gebremst wird.
Neben Einzeldüngern, die nur einen Nährstoff enthalten, werden auch Mehrkomponentendünger (z. B. Ammoniumphosphat) verwendet.
Andere Produkte aus Ammoniak
Außer zu Düngemitteln wird Ammoniak auch zu anderen wichtigen Produkten weiterverarbeitet. Im Ostwald-Verfahren wird daraus von Salpetersäure hergestellt, die eine der drei wichtigsten Säuren in der chemischen Industrie ist. Salpetersäure wiederum wird zur Synthese von Nitroverbindungen, z. B. wichtigen Sprengstoffen wie TNT (Trinitrotoluol) und Nitrocellulose, benötigt.
In der organisch-chemischen Industrie wird Ammoniak u. a. über mehrere Stufen zu Kunststoffen und Chemiefasern weiterverarbeitet, z. B. zu Polyacrylnitril, Polyamiden, z. B. Nylon, oder Harnstoffharzen.

