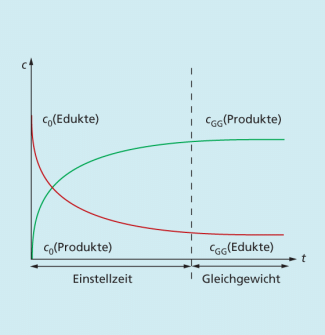
Einstellung des chemischen Gleichgewichts
Im chemischen Gleichgewicht laufen Hin- und Rückreaktion in einem geschlossenen System gleichzeitig mit derselben Geschwindigkeit ab. Obwohl die Konzentrationen der Edukte und der Produkte konstant sind, findet auf Teilchenebene ein Stoffumsatz statt, sodass man von einem dynamischen Gleichgewicht spricht.
Die Reaktion von Essigsäure und Ethanol zu Essigsäureethylester und Wasser in einem Reaktionskolben mit Rückflusskühler verläuft unvollständig und ist umkehrbar. Zu Beginn ist die Reaktionsgeschwindigkeit der Ester- und Wasserbildung (Hinreaktion) groß, weil die Konzentration der beiden Ausgangsstoffe ebenfalls groß ist.
Im weiteren Verlauf nimmt die Geschwindigkeit der Hinreaktion immer mehr ab, während die der Rückreaktion, die Bildung von Säure und Alkohol, aufgrund der steigenden Ester- und Wasserkonzentration im System schneller abläuft. Nach einer bestimmten Zeit wird ein Zustand erreicht, bei dem in der gleichen Zeit so viel Ester und Wasser gebildet werden, wie aus Ester und Wasser wieder Alkohol und Säure entstehen. Die Geschwindigkeiten der Hin- und Rückreaktion sind jetzt gleich groß (Bild 1).
-
Einstellung der Geschwindigkeiten der Hin- und Rückreaktion
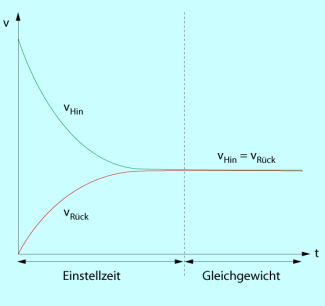
In diesem Zustand ist makroskopisch keine Reaktion mehr wahrnehmbar, da die Konzentrationen aller beteiligten Stoffe konstant bleiben. Die Reaktion befindet sich im chemischen Gleichgewicht (Bild 2). Dennoch findet auf der Teilchenebene weiterhin eine ständige Umwandlung von Alkohol- und Säuremolekülen zu Ester- und Wassermolekülen statt, während gleichzeitig genauso viele Produktmoleküle die Rückreaktion eingehen.
Im chemischen Gleichgewicht laufen Hin- und Rückreaktion in einem geschlossenen System gleichzeitig mit derselben Geschwindigkeit ab. Obwohl die Konzentrationen der Edukte und der Produkte konstant sind, findet auf Teilchenebene ein Stoffumsatz statt, sodass man von einem dynamischen Gleichgewicht spricht.
Die Zeit bis zur Einstellung der konstanten Konzentrationen nennt man Einstellzeit des chemischen Gleichgewichts. Die Einstellzeiten sind abhängig von der Aktivierungsenergie der Reaktion und reichen von wenigen Sekundenbruchteilen bis zu nahezu unendlichen Zeitspannen von vielen Jahren.
Die Einstellzeit ist für eine gegebene Reaktion spezifisch und kann durch Katalysatoren verändert werden.
Betrachten wir beispielsweise die Bildung von Ammoniak aus den Elementen Stickstoff und Wasserstoff.
Die Reaktion ist thermodynamisch eigentlich schon bei Raumtemperatur möglich. Sie verläuft jedoch unendlich langsam, sodass sich ein Gleichgewicht erst nach vielen Jahren einstellen würde. Die Reaktionsgeschwindigkeit kann durch Erhöhung der Temperatur und Verwendung eines Katalysators beschleunigt werden. Bei Temperaturen oberhalb 400°C und unter Nutzung eines Eisenoxid-Katalysators stellt sich das Gleichgewicht innerhalb so kurzer Zeit ein, dass die Reaktion zur technischen Ammoniaksynthese genutzt werden kann.
Da bei einer Gleichgewichtsreaktion die Produkte ab einer bestimmten Konzentration immer wieder zu den Edukten zurückreagieren, kann man so keinen vollständigen Stoffumsatz errzielen. Dies ist natürlich gerade für industrielle Anforderungen ungünstig. Allerdings kann man die Ausbeute bei Gleichgewichtsreaktionen durch einen einfachen Trick trotzdem deutlich erhöhen. Mann muss dazu lediglich Einfluss auf die Konzentrationen der Stoffe nehmen. Dazu hat man prinzipiell zwei Möglichkeiten. Entweder man erhöht die Konzentration eines der Edukte oder man entfernt kontinuierlich das entstehende Produkt und verringert dadurch dessen Konzentration im Reasktionsgemisch. Dadurch wird das System daran gehindert den Gleichgewichtszustand zu erreichen und es wird ständig Produkt gebildet. Dies lässt sich auch technisch nutzen.
-
Einstellung der konstanten Konzentrationen des chemischen Gleichgewichtes