Elemente der 5. Hauptgruppe – Eigenschaften und wichtige Verbindungen
Das bekannteste Element der 5. Hauptgruppe ist der Stickstoff. Er ist mit 78 Vol.-% Hauptbestandteil der Luft. Neben Stickstoff gehören die Elemente Phosphor, Arsen, Antimon, und Bismut zur 5. Hauptgruppe. Stickstoff und Phosphor sind Nichtmetalle, Arsen und Antimon Halbmetalle, und Bismut ist ein Metall.
Die Häufigkeiten der Elemente in der Erdkruste liegen ungefähr bei einem Verhältnis von 5 000 (Stickstoff) : 1 500 (Phosphor) : 9 (Arsen) : 0,3 (Bismut).
Gruppeneigenschaften
Zur fünften Hauptgruppe gehören die Elemente Stickstoff (N), Phosphor (P), Arsen (As), Antimon (Sb) und Bismut (Bi). Sie besitzen fünf Außenelektronen und erreichen die Edelgaskonfiguration durch Aufnahme von drei Elektronen bzw. durch Ausbildung von drei Atombindungen.
Der Metallcharakter nimmt innerhalb der Gruppe nach unten zu. Während Stickstoff ein typisches Nichtmetall ist, zählt das Element Bismut zu den Metallen. Phosphor ist ein Nichtmetall, eine seiner Modifikationen, der schwarze Phosphor, ist jedoch ein Halbleiter und somit halbmetallisch. Arsen und Antimon sind Halbmetalle.
Mit steigender Ordnungszahl nehmen innerhalb der Gruppe die Schmelz- und Siedepunkte zu, wobei Bismut eine Ausnahme darstellt. Die Elektronegativität und die Ionisierungsenergie nehmen in der gleichen Reihenfolge ab.
Der saure Charakter der Oxide und Säuren nimmt mit steigender Ordnungszahl ab. Beim Lösen von Stickstoffdioxid und von Phosphoroxiden in Wasser entstehen Säuren, Bismut(III)-oxid hat basische Eigenschaften.
Eigenschaften der Elemente
Stickstoff ist eine Molekülverbindung, seine Moleküle bestehen aus zwei Stickstoffatomen, die durch eine Dreifachbindung (drei Atombindungen) miteinander verbunden sind. Aufgrund dieser Dreifachbindung ist Stickstoff sehr stabil und reaktionsträge. So ist Stickstoff nicht brennbar und unterhält Verbrennungsvorgänge nicht. Er wird daher als Schutzgas z. B. beim Schweißen oder bei chemischen Reaktionen, die sauerstofffrei durchgeführt werden müssen, verwendet. Abgesehen davon dient flüssiger Stickstoff als Kühlmittel z. B. zum schnellen Gefrieren oder Gefriertrocknen von Lebensmitteln.
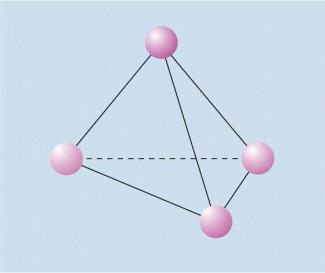
Phosphor kommt in mehreren Modifikationen vor, man unterscheidet weißen, roten, violetten und schwarzen Phosphor. Ausgangsstoff für alle Modifikationen ist der weiße Phosphor, der aus -Molekülen besteht, in denen vier Phosphoratome über Atombindungen so verbunden sind, dass die vier Atome die Ecken eines Tetraeders darstellen (Bild 4). Durch Erhitzen von weißem Phosphor mit oder ohne Druckerhöhung erhält man die übrigen Modifikationen.
Der größte Teil des hergestellten Phosphors wird zur Herstellung von Phosphorsäure verwendet, die wiederum zur Produktion z. B. von Düngemitteln und Waschmitteln benötigt wird. Abgesehen davon ist Phosphor zusammen mit Glaspulver in den Reibeflächen von Streichholzpackungen enthalten.
-
Tetraedermodell des weißen Phosphors
Arsen besitzt wie Phosphor mehrere Modifikationen, von denen graues Arsen die stabilste ist. Graues Arsen ist von der Struktur her dem schwarzen Phosphor ähnlich, seine Kristalle sind spröde, metallisch glänzend und leiten den elektrischen Strom. Bei 616 °C sublimiert es, der Dampf besteht aus -Molekülen, die in ihrer Struktur dem weißen Phosphor entsprechen. Kühlt man den Dampf schnell ab, bildet sich gelbes Arsen, das nichtmetallisch und instabil ist und sich bei Zimmertemperatur allmählich in graues Arsen umwandelt.
Arsen wird als Legierungsbestandteil zur Erhöhung der Härte verwendet. Galliumarsenid und Indiumarsenid sind wichtige Halbleiter, z. B. für die Herstellung von LED und Lasern.
Antimon kommt ebenfalls in mehreren Modifikationen vor, die hier nicht näher beschrieben werden sollen. Die stabilste Modifikation ist metallisches (graues) Antimon, das in seiner Struktur dem grauen Arsen entspricht und ebenso wie dieses aus spröden, glänzenden Kristallen besteht (Bild 5).
Antimon wird hauptsächlich als Legierungsbestandteil verwendet.
Bismut tritt nur in einer einzigen metallischen Modifikation auf. Es ist ein sprödes, silberweiß glänzendes Metall mit einem leichten rötlichen Schimmer. Genutzt wird es zur Herstellung von leicht schmelzenden Legierungen, die z. B. in Schmelzsicherungen verwendet werden.
-
Antimon

Heinz Mahler, Berlin
Vorkommen und Gewinnung
Stickstoff kommt elementar als in der Luft mit einem Volumenanteil von 78,09 % vor. In chemisch gebundener Form ist Stickstoff im Chilesalpeter (Natriumnitrat, ) enthalten. Außerdem ist chemisch gebundener Stickstoff Bestandteil von Aminosäuren und den daraus aufgebauten Peptiden (Eiweißen).
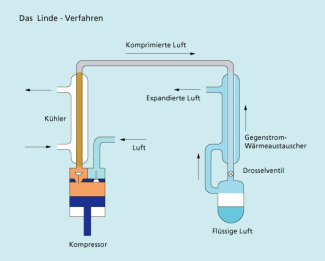
Die technische Gewinnung von Stickstoff erfolgt wie die Gewinnung von Sauerstoff durch fraktionierende Destillation von flüssiger Luft im Linde-Verfahren (Bild 6).
Beim LINDE-Verfahren wird die Luft auf 200 bar komprimiert und die dabei entstehende Wärme durch Kühlen abgeführt. Über ein Drosselventil wird dann die Luft entspannt, wobei sie sich infolge der dabei geleisteten Arbeit abkühlt (JOULE-THOMSON-Effekt). Der Prozess wird wiederholt, bis die Luft kondensiert.
Im Labor lässt sich Stickstoff durch thermische Zersetzung von Natriumazid gewinnen. Diese Reaktion wird auch zum Aufblasen von Airbags genutzt – bei 25 °C entstehen aus 10 g Natriumazid knapp 4 l Stickstoff, bei den hohen Temperaturen, die durch die Reaktion herrschen, wird das Gasvolumen entsprechend größer.
Phosphor ist sehr reaktiv und kommt deshalb in der Natur nur in gebundener Form vor. Die wichtigsten Mineralien sind die Phosphate, z. B. Apatit .
Hydroxylapatit , , bildet die Knochensubstanz bei Wirbeltieren. Auch sonst haben Phosphate große Bedeutung im Organismus. Sie kommen u. a. in der DNA und im Energieträger ATP (Adenosintriphosphat) vor.
Hergestellt wird elementarer Phosphor aus Calciumphosphat, das im Lichtbogenofen bei 1 400 °C mit Koks reduziert wird. Als Schlackenbildner wird außerdem Quarzsand zugesetzt.
Arsen kommt in der Natur nur selten elementar als Scherbencobalt vor, sondern meist als Arsenid. Beispiele für arsenhaltige Mineralien sind Arsenkies (FeAsS) und Glanzcobalt (CoAsS).
Arsen wird hergestellt, indem Arsenkies unter Luftabschluss erhitzt wird.
Antimon findet man in der Natur, oft mit einem hohen Arsengehalt, als Sulfid oder als Antimonid. Das häufigste Antimonmineral ist Grauspießglanz ().
Zur Herstellung von Antimon werden zwei Verfahren angewendet, wobei als Ausgangsstoff Antimonsulfid (Grauspießglanz) dient.
Beim Niederschlagsverfahren verwendet man als Reduktionsmittel Eisen, das mit dem Antimonsulfid verschmolzen wird:
Beim Röstreduktionsverfahren wird Grauspießglanz zuerst geröstet, d. h. an der Luft erhitzt. Das hierbei entstehende Antimonoxid wird anschließend mit Kohle reduziert.
Rösten:
Reduktion:
Bismut liegt in der Natur gebunden an Schwefel oder Sauerstoff vor. Die bedeutendsten Mineralien sind Bismutocker () und Bismutglanz ().
Elementares Bismut erhält man aus oxidischen Erzen durch Reduktion mit Kohle:
Will man Bismut aus sulfidischen Erzen gewinnen, wendet man wie bei der Herstellung von Antimon das Niederschlags- oder das Röstreduktionsverfahren an.
-
Linde-Verfahren (schematisch)
Wichtige Verbindungen
Stickstoffverbindungen
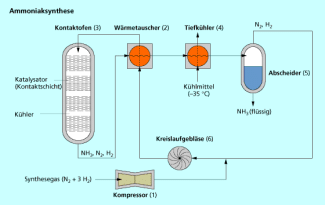
Stickstoff bildet mit Wasserstoff Ammoniak (). Ammoniak ist ein farbloses Gas, das einen charakteristischen Geruch besitzt. Es ist leichter als Luft und gut in Wasser löslich. Die großtechnische Herstellung erfolgt nach dem Haber-Bosch-Verfahren (Bild 7).
Das Ammoniak-Molekül ist pyramidal aufgebaut, die Bindungen innerhalb des Moleküls sind polare Atombindungen.
Ammoniak reagiert in Wasser schwach basisch, da sich durch eine Protolysereaktion Hydroxid-Ionen bilden.
Andererseits kann es auch ein Proton abgeben, beispielsweise bei der Reaktion mit Metallen, wobei Wasserstoff und Amide
(), Imide () oder Nitride gebildet werden.
Beispiel: Bildung von Natriumamid:
Stickstoffoxide
Stickstoff bildet zahlreiche Oxide.
Distickstoffmonooxid () wird auch Lachgas genannt, da es eingeatmet Halluzinationen hervorruft. Es wird in der Medizin als Narkosemittel (Anästhetikum) verwendet. Gemische von und explodieren beim Entzünden wie Knallgas.
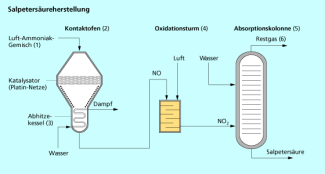
Stickstoffmonooxid (NO) ist ein farbloses, giftiges Gas. Es ist ein Zwischenprodukt bei der Salpetersäureherstellung nach dem OSTWALD-Verfahren. Mit Sauerstoff reagiert NO schnell zu .
Stickstoffdioxid () ist ein braunes, giftiges Gas. Oberhalb von 150 °C zersetzt es sich in Sauerstoff und Stickstoffmonoxid. Es ist ebenfalls ein Zwischenprodukt der Salpetersäureherstellung.
Als nitrose Gase werden Mischungen von Stickstoffmonooxid und Stickstoffdioxid bezeichnet . Sie entstehen u. a. bei der Verbrennung von Vergaserkraftstoffen. Da sie zur Entstehung des sauren Regens beitragen, müssen sie durch geeignete Katalysatoren in Stickstoff und Wasser überführt werden. Außerdem trägt Stickstoffdioxid zur Bildung von bodennahem Ozon und somit zum Sommersmog bei. Durch Einwirkung von Sonnenlicht wird ein Sauerstoffatom abgespalten. Es bilden sich Sauerstoffradikale, die mit Luftsauerstoff zu Ozon, einem gesundheitsschädlichen Gas reagieren.
Stickstoffhaltige Säuren
Die wichtigsten stickstoffhaltigen Säuren sind die Salpetersäure und die Salpetrige Säure.
Salpetersäure und ihre Salze
Salpetersäure ist eine starke Säure. Mit Wasser bildet sie Hydronium-Ionen und Nitrat-Ionen.
-
Ammoniaksynthese (schematisch)
Salpetersäure ist in der chemischen Industrie von großer Bedeutung, hauptsächlich als Ausgangsstoff zur Herstellung von Düngemitteln. Sie wird großtechnisch beim Ostwald-Verfahren aus Ammoniak hergestellt (Bild 8).
Salpetersäure ist ein starkes Oxidationsmittel, konzentrierte Salpetersäure löst Edelmetalle wie Kupfer und Silber. Weil Gold von Salpetersäure nicht angegriffen wird, lässt sich Silber durch Salpetersäure sogar aus Silber-Gold-Legierungen herauslösen, wobei Gold zurückbleibt. Salpetersäure wird daher auch Scheidewasser genannt.
Eine Mischung von konzentrierter Salpetersäure und konzentrierter Salzsäure im Verhältnis 1:3 wird Königswasser genannt und löst fast alle Metalle, sogar Gold und Platin.
Die Salze der Salpetersäure, die Nitrate , werden hauptsächlich als Düngemittel, aber auch in Explosivstoffen eingesetzt. Schwarzpulver, der älteste Explosivstoff, besteht aus 75 % Kaliumnitrat, 15 % Holzkohle und 10 % Schwefel.
Nitrate entstehen bei der Neutralisation von Salpetersäure und bei der Reaktion von Salpetersäure mit Carbonaten oder Metallen.
Neutralisation:
Umsetzung mit Carbonaten:
Umsetzung von verdünnter Salpetersäure mit unedlen Metallen:
Salpetrige Säure und ihre Salze
Salpetrige Säure ist nur in Form ihrer Salze, der Nitrite, stabil. Sie selbst disproportioniert in Salpetersäure und Stickstoffmonooxid:
-
Ostwald-Verfahren (schematisch)
Nitrite werden z. B. in Nitritpökelsalz zur Konservierung von Fleisch- und Wurstwaren und zur Erzeugung ihres typischen Pökelgeschmacks verwendet.
Phosphorverbindungen
Phosphor bildet Oxide unterschiedlicher Zusammensetzung, z. B. Tetraphosphorhexaoxid und Tetraphosphordecaoxid .
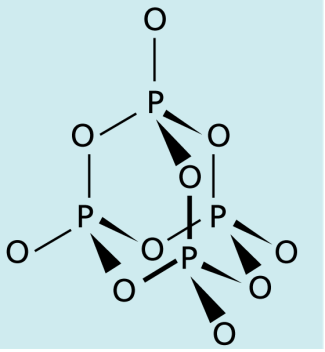
Das technisch bedeutendste Phosphoroxid ist Tetraphosphordecaoxid (Phosphor(V)-oxid), das nach dem stöchiometrischen Verhältnis der Elemente auch Phosphorpentoxid genannt wird, obwohl seine Summenformel ist (Bild 10).
Phosphorpentoxid ist ein weißes geruchloses Pulver. Es reagiert sehr heftig mit Wasser unter Bildung von Phosphorsäure.
Wegen der wasserentziehenden Wirkung wird es als Trockenmittel verwendet.
-
Struktur von Phosphorpentoxid
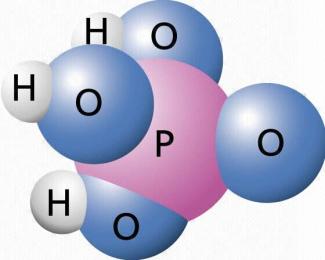
Phosphorsäure
Phosphor bildet eine Vielzahl von Säuren. Die wichtigste davon ist die Phosphorsäure . Phosphorsäure ist eine mittelstarke Säure, die drei Wasserstoff-Ionen (Protonen) abgeben kann und somit eine dreiprotonige (dreibasige) Säure ist. Sie kann durch Umsetzung von Calciumphosphat mit Schwefelsäure hergestellt werden:
-
Kugelmodell der Phosphorsäure
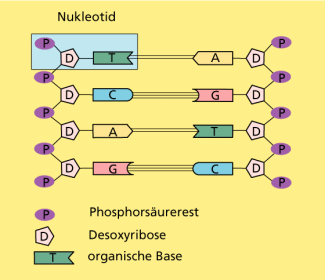
Phosphorsäuremoleküle können durch Wasserabspaltung (Kondensation) miteinander verknüpft werden, wobei lineare oder verzweigte Ketten oder ringförmige Moleküle entstehen. Solche Kondensationsreaktionen spielen im Organismus eine wichtige Rolle, z. B. bei der Umwandlung von Adenosindiphosphat (ADP) zu Adenosintriphosphat (ATP), das als Energiespeicher dient. Die Kondensation von Phosphorsäure mit Hydroxy-Gruppen führt zu Phosphorsäureestern, die z. B. in der DNA (Bild 12) vorkommen und somit ebenfalls biologisch von großer Bedeutung sind.
Bei der Neutralisation von Phosphorsäure entstehen Phosphate . Weil Phosphorsäure eine dreiprotonige Säure ist, verläuft die Neutralisation über drei Stufen, in der drei verschiedene Säurerest-Ionen gebildet werden: Zunächst entstehen Dihydrogenphosphat-Ionen (), dann Hydrogenphosphat-Ionen () und schließlich Phosphat-Ionen ().
Phosphate, vor allem Calcium- und Ammoniumphosphate, sind wichtige Düngemittel. Außerdem sind Phosphate in Waschmitteln enthalten.
Arsenverbindungen
Bei Verbrennung von Arsen an der Luft bildet sich Arsen(III)-oxid , das unter dem Namen Arsenik als Gift bekannt geworden ist. Mitte des 19. Jahrhunderts wurden 90-95 % aller (bekannt gewordenen) Giftmorde mit Arsenik ausgeführt. Nachdem Nachweismethoden für Arsenik im Leichengewebe entwickelt wurden, ging ihr Anteil deutlich zurück.
-
Struktur von DNA
Suche nach passenden Schlagwörtern
- Arsen
- Hydroxylapatit
- Stickstoffmonooxid
- Bismut
- Aminosäuren
- Arsenik
- Salpetersäure
- Lachgas
- Phosphorsäure
- Chilesalpeter
- Stickstoffgruppe
- Distickstoffmonooxid
- Salpetrige Säure
- Stickstoffdioxid
- Ammoniak
- Königswasser
- Nitrite
- 5. Hauptgruppe
- Stickstoff
- nitrose Gase
- Stickstoff-Gruppe
- Nitrate
- Phosphorpentoxid
- Fünfte Hauptgruppe
- Phosphate
- Antimon
- Stickstoffmonoxid
- Phosphor

